ニトロソアミン類混入リスクへの対策
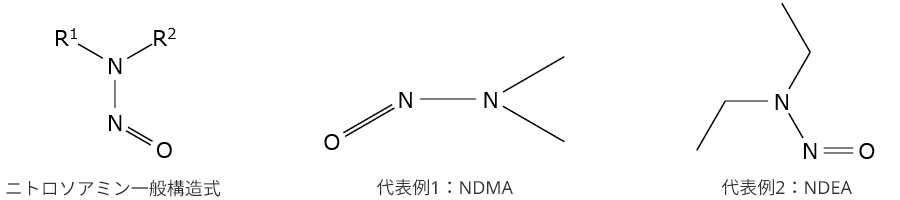
ニトロソアミン原薬関連不純物(Nitrosamine drug substance related impurities、NDSRI)は、原薬または原薬の分解物中の2級または3級アミンがニトロソ化された化合物の総称です。過日、下記のシタグリプチンを含有する医薬品からNDSRIであるNTTPが検出されたことが話題になりました。
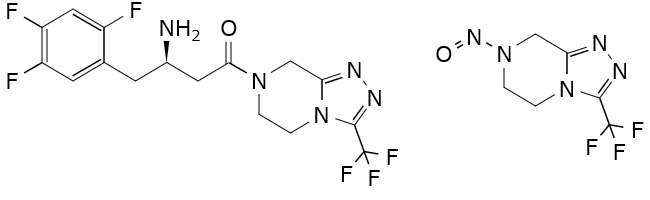
各成分の構造式(左:Sitagliptin、右:NTTP)
ニトロソアミン類は、アミン類と亜硝酸塩が反応して生成することが知られています。テトラゾール環形成などの合成経路で用いるアジド化合物の失活を目的として添加する亜硝酸塩や、試薬や賦形剤に不純物として存在する亜硝酸塩がニトロソアミン生成のリスクとなることが報告されています。
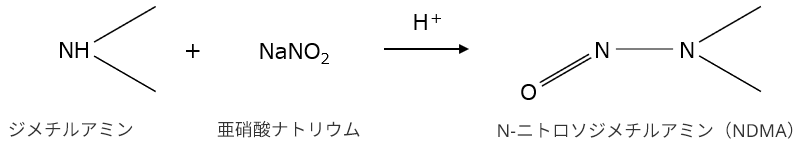
NDMAを生成する一般的な反応式(参照:FDA Control of Nitrosamine Impurities in Human Drugs)
ニトロソアミン類の混入リスクについて、2021年10月8日に厚生労働省から医薬品へのニトロソアミン類混入リスクに関する自主点検・リスク評価・限度値を超える場合のリスク低減措置の通知*1)*2)が発行されました。国内外においてサルタン系医薬品などから発がん性物質であるニトロソアミン類が検出され、関連する製品のリコールや販売中止を受けたものです。この通知は2025年8月1日にリスク低減措置期限*3)を迎えましたが、期限に関わらず今後下記に該当する場合は化学合成医薬品・生物製剤・これまでニトロソアミン類が検出されていない医薬品・限度値を超えないニトロソアミン類の混入が確認された品目*4)など、非常に幅広い医薬品を対象に点検・リスク評価・リスク低減措置の検討および薬事手続を行う必要があります。
- 新規に医薬品の承認を取得しようとするとき
- 製造方法、処方又は一次包装の変更等ニトロソアミン類の混入に影響があると考えられる変更を行おうとするとき
- ニトロソアミン類について新たな知見が得られたとき
- 医薬品におけるニトロソアミン類の混入リスクに関する自主点検について(厚生労働省 薬生薬審発 1008)
- 「医薬品におけるニトロソアミン類の混入リスクに関する自主点検について」の実施期限延長について
- 医薬品におけるニトロソアミン類の混入リスクに関する自主点検後の対応について
- ニトロソアミン類の混入リスクに関する自主点検に基づくリスク管理措置に係る薬事手続について
ニトロソアミン類の混入は、合成過程での生成・試薬や溶媒への混入・共用設備や梱包材からの混入・保存時など原因が多岐に渡るため、製造販売業者だけでなく包装容器などの製造・供給業者などと連携して点検することが求められています。
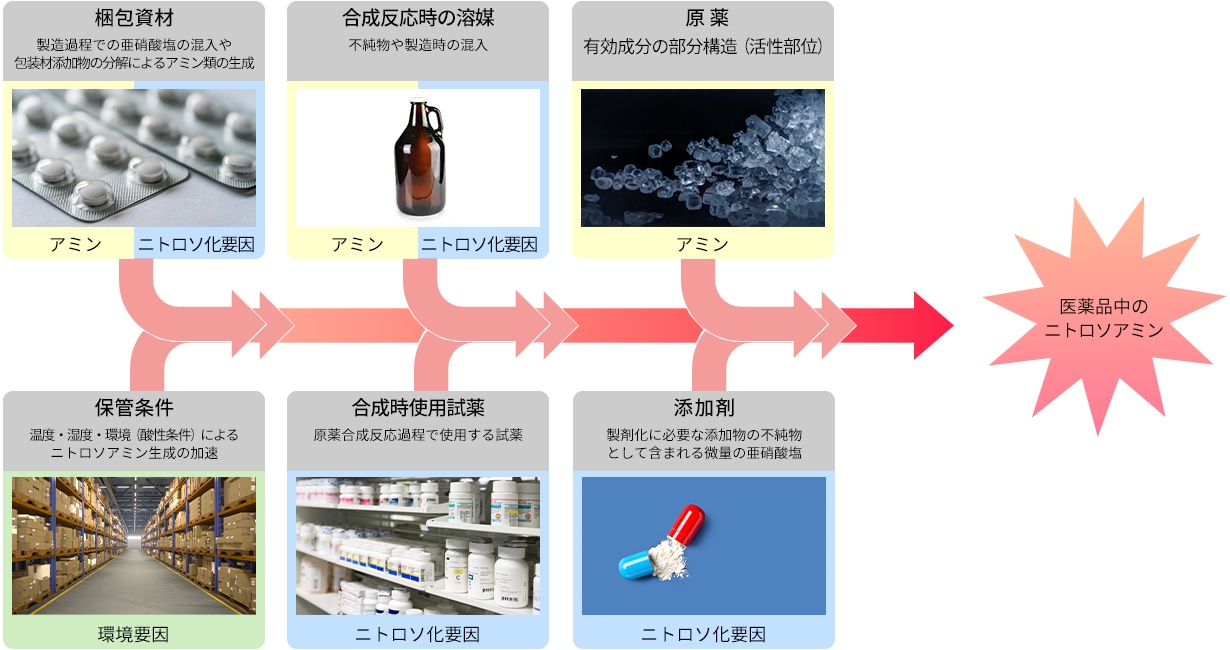
ニトロソアミン類の生成要因となる亜硝酸塩の分析については、米国 FDAのガイダンス*5)や欧州EMAのガイダンス*6)で言及されています。医薬品原材料中の亜硝酸および硝酸についてはイオンクロマトグラフで分析することが可能で、その分析事例を以下にご紹介します。
低分子ニトロソアミンの分析
厚生労働省のニトロソアミン類の混入リスク評価では、分析の対象となる既知のニトロソアミン類として以下の表に示す9種類が挙げられています。当時のFDAのガイダンスで示された6種のニトロソアミン類の他、欧州のEMAが許容摂取量を設定した*7)ニトロソアミン類も含んでいます。
厚生労働省 ニトロソアミン類の混入リスク評価で示された既知のニトロソアミン類
| ニトロソアミン類 | 許容摂取量(ng/日) |
|---|---|
| N-ニトロソジメチルアミン(NDMA) | 96.0 |
| N-ニトロソジエチルアミン(NDEA) | 26.5 |
| N-ニトロソ-N-メチル-4-アミノ酪酸(NMBA) | 96.0 |
| N-ニトロソメチルフェニルアミン(NMPA) | 34.3 |
| N-ニトロソイソプロピルエチルアミン(NIPEA) | 26.5 |
| N-ニトロソジイソプロピルアミン(NDIPA) | 26.5 |
| メチルニトロソピペラジン(MeNP) | 26.5 |
| N-ニトロソジブチルアミン(NDBA) | 26.5 |
| N-ニトロソモルホリン(NMOR) | 127 |
(参照:厚生労働省 薬生薬審発1008 第1号
厚生労働省の通知にある9種のニトロソアミン類は、LC-MS/MS法で一斉分析ができます。また、2021年に公開された米国薬局方(UPS)General Chapter <1469>の分析メソッドには、 LC-MS/MS法およびGC-MS/MS法が示されています。分析事例を以下にご紹介します。
ニトロソアミン原薬関連不純物(NDSRI)の分析
NDSRIなど新規のニトロソアミン類が確認された場合には、ICH M7(R2)を参考に一生涯曝露を想定した許容摂取量(Acceptable Intake, AI)を設定するなど、科学的に妥当な方法で混入ニトロソアミン類の最高許容濃度を設定するために時間や費用がかかるといった問題がありました。2023年7月にEMA*8)が、また2023年8月にFDA*9)が、NDSRIの構造のみから簡単にAIを設定する方法(Carcinogenic Potency Categorization Approach, CPCA)を提示しました。日本においても、厚生労働省がCPCAを用いてAIを設定することを許容する旨の事務連絡*10)を出しており、AI設定の効率化がはかられています。 NDSRIの許容摂取量は、その化学構造に応じてCategory1(18 ng/日)からCategory5(1,500 ng/日)と幅広い値が設定されます。許容摂取量が多い物質については高感度な分析機器が不要となり、簡便な機器で測定可能な場合もあります。これらの化合物はより簡便に導入できるシングル四重極型LC-MSでも分析可能です。NDSRIのLC-MSおよびLC-MS/MSによる分析事例を以下にご紹介します。
- EMA Questions and answers
- Recommended Acceptable Intake Limits for Nitrosamine Drug Substance-Related Impurities | FDA
- 「「医薬品におけるニトロソアミン類の混入リスクに関する自主点検 について」に関する質疑応答集 (Q&A) について」の一部改正について