1.2. 質量とは
質量分析とは「質量情報を得る手法」ですが、ここで言う質量とは、体重計や電子天秤で量る重さとはスケールが大きく異なります。質量分析では電場や磁場を利用して測定された値から非常に小さなスケールの質量情報を得ることが可能であり、原子や分子の質量を知ることができます。
1.2.1. 原子とは
あらゆる物質は、原子と呼ばれる極めて小さな粒子から構成されています。原子は物質を形作る基本構成単位であり、これが集まることで分子、あるいは形態としての固体、液体、気体といった物質が形成されます。
原子は、原子核とその周囲を取り巻く電子から構成されます。原子核は陽子と中性子で構成されます。陽子は正の電荷を持ち、電子は負の電荷を持ちます。中性子は電荷を持たないため電気的に中性です。
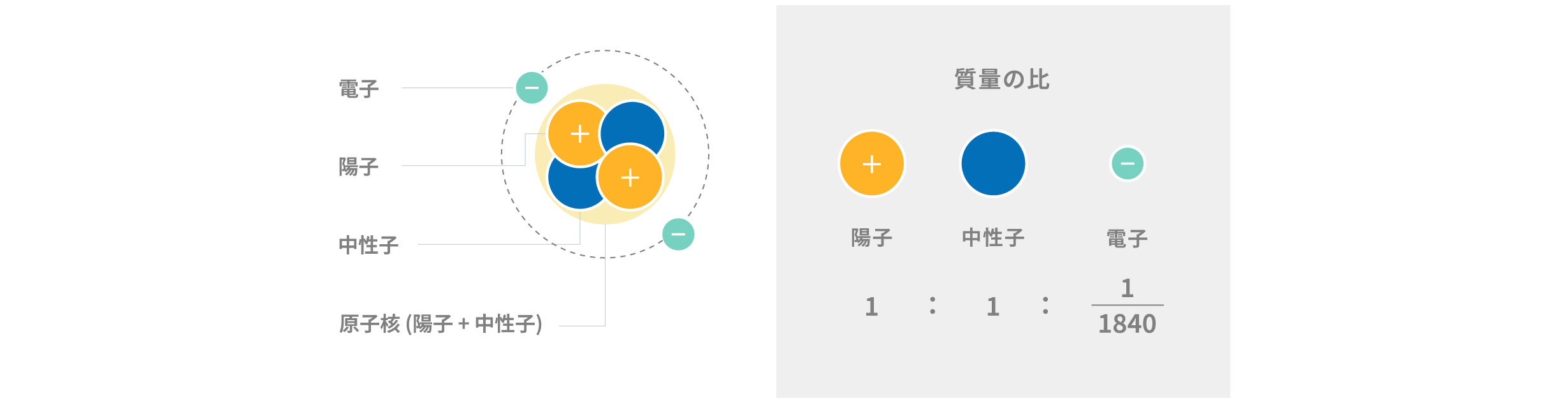
原子核を取り巻く電子の数は、通常状態では陽子の数と等しくなります。陽子と中性子の質量はほぼ同じですが、電子の質量は陽子の質量の約1840分の1しかありません。そのため、原子や分子の質量は陽子と中性子の数でほぼ決定されます。
1.2.2. 元素と同位体
原子の性質は陽子と中性子の数の違いによって異なります。陽子の数は原子番号と呼ばれ、原子番号が同じであれば同じ元素に分類されます。元素は原子の種類を区別する基本的な要素です。つまり、陽子の数が異なる原子は化学的性質が異なるため、異なる元素であるといえます。一方、陽子と中性子を合わせた数のことは質量数と呼ばれます。同じ元素でも中性子の数が異なると、化学的性質は同じままですが、異なる質量数を持つ同位体となります。

1.2.3. 分子とは
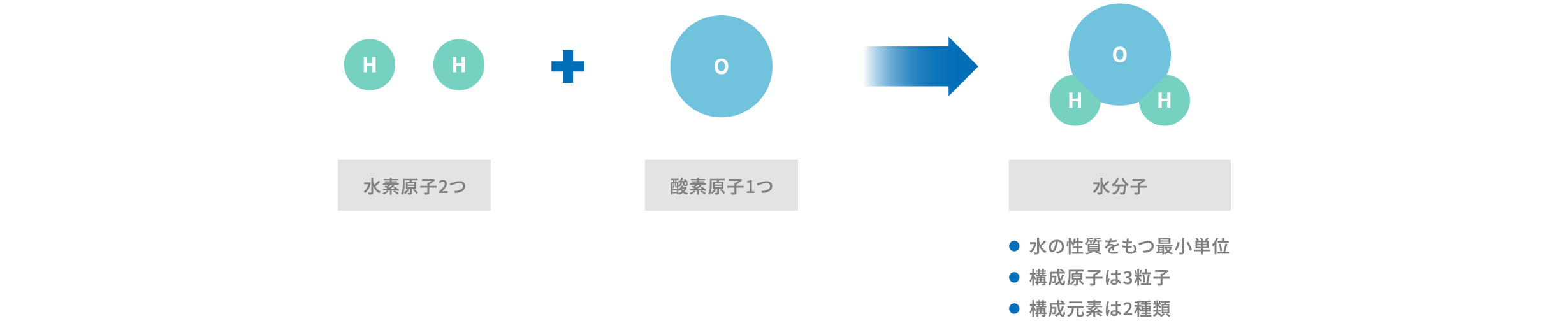
原子どうしが結合すると、より複雑な構造である分子となります。分子は複数の原子が化学結合によって結びついたものであり、物質の特性を決定する基本的な単位でもあります。例えば、水分子 (H2O) は、2つの水素原子と1つの酸素原子が共有結合することによってその特性を示します。こうした分子構造の組み合わせによって、私たちの身の回りに存在する物質の多様性が生まれます。
1.2.4. 統一原子質量単位 (unified atomic mass unit) とは
原子や分子の1つずつの質量は非常に小さいため、グラムやキログラムのような単位で表現するのは非常に不便です。そのため、質量分析では原子や分子の質量に統一原子質量単位が使用されます。
統一原子質量単位は、静止した基底状態 (有結合していない) の質量数12の炭素原子 (12C) 1原子の質量の12分の1の質量と定義されており、記号はu (ユー) を用います。
1 uは 1.660 539 068 92 (52) × 10-27 kgであり、カッコ内の数値は不確かさを示します。

統一原子質量単位を用いて小数点以下3桁以降まで表される質量は計算精密質量 (calculated exact mass) と呼び、質量分析のおいて重要な情報となります。
コラム「原子質量単位 (atomic mass unit; amu)」
統一原子質量単位は1960年に定義されましたが、それまでは原子質量単位としてamuという単位が用いられていました。これは酸素原子1原子の質量の16分の1の質量と定義されています。非常に似た名称の単位ですが、統一原子質量単位とは定義が全く異なります。
さらに、物理学の分野では質量数16の酸素原子1原子の16分の1をamuとしていましたが、amuが定義された1898年にはまだ同位体が発見されていなかったことから、化学の分野では酸素原子の同位体存在比を考慮した平均値 (原子量) の16分の1をaumとして使用していました。この違いは高精度な測定に大きな影響を与えます。
単位の二面性が引き起こす混乱を解消するために新たに定義されたのが”統一”原子質量単位だったというわけです。こうした理由から、現在では質量分析においてamuを使用することは不適切であるとされています。
ちなみに、酸素原子ではなく炭素原子が採用された背景としては、炭素原子を採用した方がamuを使用した質量との差が小さくなることが挙げられています。
また、1993年に統一原子質量単位の記号としてDa (ダルトン) の使用が提案され、2005年に承認されています。主に生化学の分野で使用されるDaは、uと全く同じように使用できます。
コラム「アボガドロ定数の定義」
分析機器の発展により、2018年に国際単位系 (SI)の再定義が行われ、2019年に施行されました。このとき、アボガドロ定数NAは、従来の「0.012 kgの12Cのなかに含まれる原子の数」という定義から 6.022 140 76 × 1023 mol-1という具体的な数値へと変更されました。そのため、2019年以前と以降の文献等で扱われているアボガドロ定数は厳密には異なる場合がある点に注意が必要です。
現在では質量数12の炭素原子 (12C) 1 molの質量は 12.000 000 0000 × 10-3 kgではなく12.000 000 0126 (37) × 10-3 kgという実験値となっています。

ちなみにアボガドロ数 6.022 × 1023 を指数を使わずに言うと、6022垓 (がい) となります。


