1.3. イオン化と質量分離
1.3.1. イオン化とは
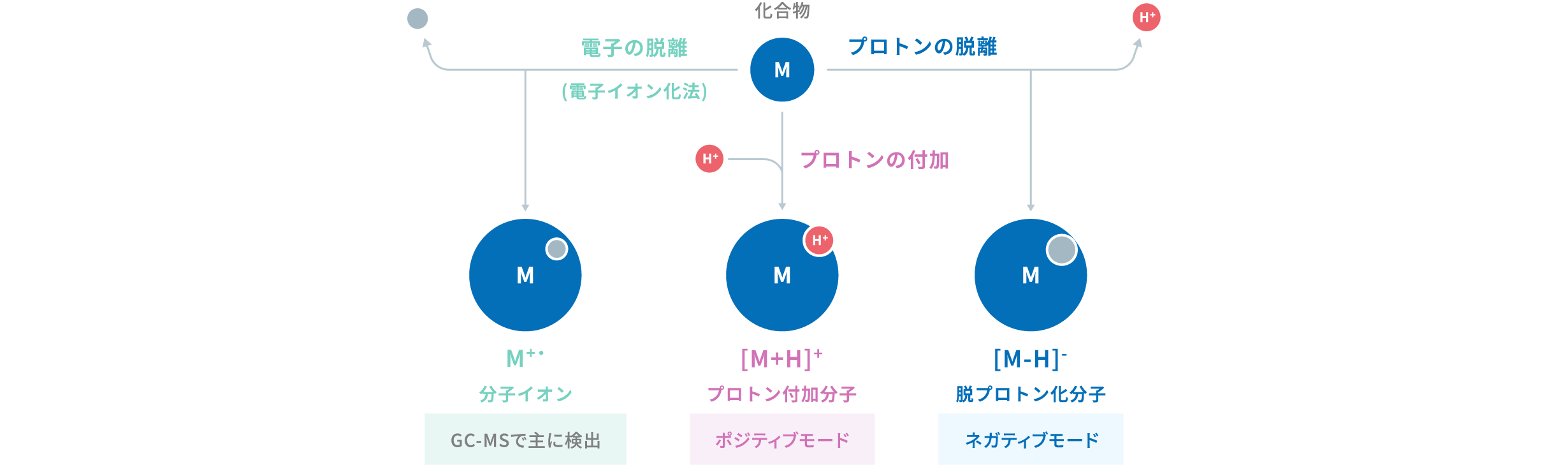
質量分析では、質量と電荷数の違いを用いて分離・検出するために原子や分子をイオン化する必要があります。イオンとは電荷を帯びた粒子 (荷電粒子) の一種であり、LC-MSで化合物がイオン化されると、プロトンが脱離した脱プロトン化分子 [M-H]-、またはプロトンが付加したプロトン付加分子 [M+H]+ となります。脱プロトン化分子はネガティブモード、プロトン付加分子はポジティブモードで検出されます。これに対してGC-MS (ガスクロマトグラフ質量分析計) のイオン化では、一般的に化合物は電子を放出し、正に帯電して分子イオンM+・となります。
1.3.2. フラグメントイオンとは
イオン化した化合物は、不活性ガスと衝突させると開裂してフラグメントイオンを生成します。このように不活性ガスとの衝突を利用してイオンを開裂させることを衝突誘起解離 (Collision-Induced-Dissociation, CID) と呼びます。CIDでは結合エネルギーの低い部分から切断されるため、開裂のパターンは分子構造を反映した特徴が表れます。
特定のイオン (プリカーサイオン) から生成されたフラグメントイオンはプロダクトイオンと呼ばれます。化合物がプリカーサイオンのまま検出器に到達すると化合物の質量に関わる情報が得られますが、CIDにより生じたプロダクトイオンを検出すると化合物の部分構造に関する情報が得られるようになります。プリカーサイオンやプロダクトイオンを観察することで、化合物の分子構造を推定することが可能となります。

1.3.3. m/z とは
質量分析では、イオンは質量と電荷数の違いにより分離されますが、正確には m/z (読み方:エム オーバー ジィー) の違いにより分離されます。
m/z とは「イオンの質量を統一原子質量単位で割って得られる相対質量をイオンの電荷数で割って得られる無次元量 (日本質量分析学会 マススペクトロメトリー関係用語集第4版より)」と定義されています。つまり、統一原子質量単位を用いて表されるイオンの質量 (m) をイオンの電荷数 (z) で割った値となります。

m/z は必ず小文字の斜体で表記します。また、m/z の数値を示す際は「m/z = 100」というように等号は使用せず、「m/z 100」のようにスペースのみをはさんで表記します。
コラム「質量を統一原子質量単位で割って得られる相対質量」
m/z の定義を説明する文章に「質量を統一原子質量単位で割って得られる相対質量」という文言が登場します。一読しただけではわかりにくいですが、これは原子や分子の質量を統一原子質量単位を用いて表した値と一致します。質量数12の炭素原子 (12C) を例に計算してみましょう。
12Cの質量を実験的に求めると0.012 000 000 0126 kg mol-1 になるとされています。アボガドロ定数6.022 140 76 × 1023 mol-1 より、12Cの1原子の質量は1.992 646 88 × 10-26 kgとなります。統一原子質量単位1 uは1.660 539 068 × 10-27 kgなので、これで割ると12.000 000 00となります。この数値はkgで表される値をkgで表される値で割った結果なので単位はつきません (無次元量)。12Cを統一原子質量単位で表した計算精密質量は12.000 0000 uなので、ぴったり一致します。
コラム「質量電荷比」
m/z は質量電荷比と呼ばれることがありますが、「電荷」と「電荷数」では意味が異なるので誤りです。電荷数 (charge number) はイオンの総電荷量の絶対値を電気素量で割った量ですが、電荷 (electric charge) は帯電したものが持っている電気の量のことを指します。m/z を日本語で正しく表現するなら「相対質量電荷数比」となります。
1.3.4. 高分解能質量分析計 (High-Resolution Mass Spectrometer, HRMS)
高分解能質量分析計は小数点以下の質量まで精密に測定できるため、分子を構成する原子の組成を推定することが可能です。たとえば、ある化合物を低分解能のMSで分析したところ、質量が28.0であることがわかりました。このとき、元素の組成はCO、N2、C2H4が予想されますが、決定することはできません。一方、高分解能質量分析計を用いると質量は28.031であることがわかりました。これはC2H4の計算精密質量に最も近いため、この化合物はC2H4であることがわかります。このように小数点以下の精密質量がわかると、その化合物の組成を決定することが可能となります。

LC-MSで分析される分子を構成する主な元素の計算精密質量、同位体存在度を次に示します。高分解能質量分析計を用いて化合物の組成を推定する際はこれらの情報が使用されます。
| 同位体 Isotope |
計算精密質量 (u) Calculated Exact Mass |
同位体存在度 Isotopic Composition |
標準原子量 Standard Atomic Weight |
|
|---|---|---|---|---|
| H D |
1 2 |
1.007 825 032 23(9) 2.014 101 778 12(12) |
0.999 885(70) 0.000 115(70) |
[1.007 84, 1.008 11] |
| C |
12 |
12.000 0000(00) 13.003 354 835 07(23) |
0.9893(8) 0.0107(8) |
[12.0096, 12.0116] |
| N |
14 15 |
14.003 074 004 43(20) 15.000 108 898 88(64) |
0.996 36(20) 0.003 64(20) |
[14.006 43, 14.007 28] |
| O |
16 17 18 |
15.994 914 619 57(17) 16.999 131 756 50(69) 17.999 159 612 86(76) |
0.997 57(16) 0.000 38(1) 0.002 05(14) |
[15.999 03, 15.999 77] |
| F | 19 | 18.998 403 162 73(92) | 1 | 18.998 403 163(6) |
| P | 31 | 30.973 761 998 42(70) | 1 | 30.973 761 998(5) |
| S |
32 |
31.972 071 1744(14) 32.971 458 9098(15) 33.967 867 004(47) 35.967 080 71(20) |
0.9499(26) 0.0075(2) 0.0425(24) 0.0001(1) |
[32.059, 32.076] |
| Cl |
35 37 |
34.968 852 682(37) 36.965 902 602(55) |
0.7576(10) 0.2424(10) |
[35.446, 35.457] |
| Br |
79 81 |
78.918 3376(14) 80.916 2897(14) |
0.5069(7) 0.4931(7) |
[79.901, 79.907] |
1.3.5. モノアイソトピック質量とモストアバンダント質量
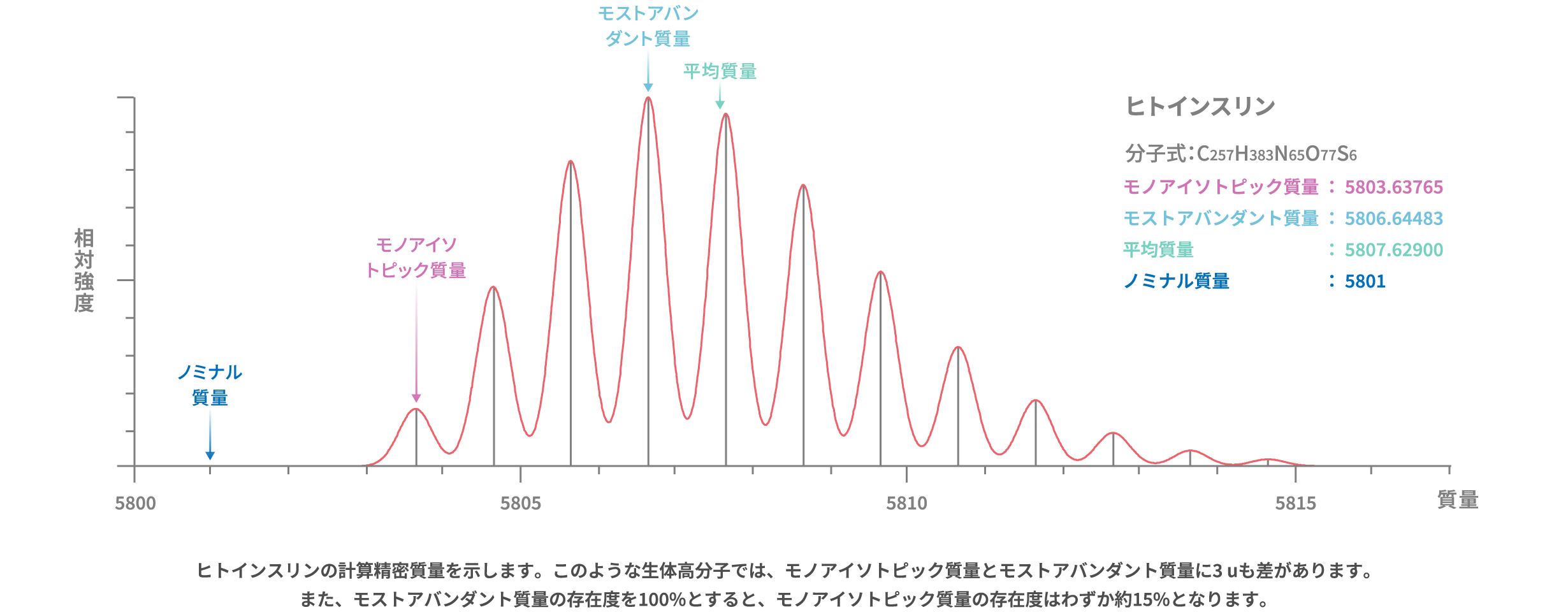
質量分析では同位体ごとの質量を得ることができるため、個々の同位体組成に基づいた精密質量が重要になります。特に「各元素について天然における同位体存在度が最大の同位体の質量を用いて計算したイオンまたは分子の計算精密質量 (日本質量分析学会 マススペクトロメトリー関係用語集第4版より)」はモノアイソトピック質量と呼ばれ、化合物の同定や構造解析、分析メソッドの構築において重要な情報となります。
各元素について天然における同位体存在度が最大の同位体のみを含むイオンはモノアイソトピックイオン、モノアイソトピックイオンに由来するピークはモノアイソトピックイオンピークと呼ばれます。他の同位体を含むイオンに由来するピークは同位体イオンピークと呼ばれます。
また、あるイオンまたは分子において存在度が最大となる組み合わせの同位体の質量はモストアバンダント質量と呼ばれます。たんぱく質のような生体高分子などでは、モストアバンダント質量の存在度がモノアイソトピック質量の10倍以上になることもあり、分析対象の定性や検出に必要な情報となります。
コラム「同位体の組成」
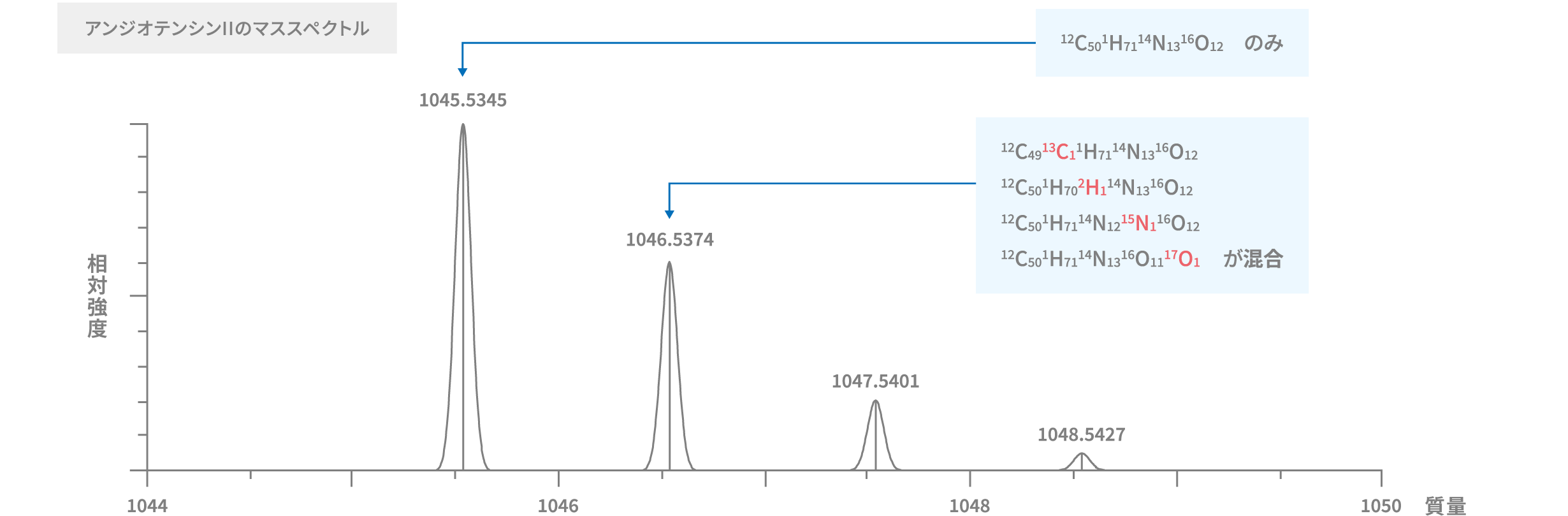
多くの元素には同位体が存在します。C50H71N13O12から構成されるアンジオテンシンIIというペプチドを例に見ますと、モノアイソトピック質量は12Cと1Hと14Nと16Oから構成される分子のみとなります。しかしながら質量が1 u大きい同位体には、モノアイソトピック質量の分子を構成する原子に加え、13C、2H、15N、17Oのいずれか一つを含む4種類の分子が混在しています。それぞれの分子の質量は異なりますが、その差はごくわずかであるため分離は困難です。また、それぞれの分子の質量を計算することは可能ですが、同位体存在度を加味して正確に平均値を算出することも困難です。そのため基本的には、確実に計算できるモノアイソトピック質量を用いて定性を行います。
コラム「原子量と分子量」
原子や分子の質量を、原子量 (相対原子質量) や分子量 (相対分子質量) と表現している場合があります。これらは同位体存在度を加味した平均の質量を示します。質量分析で得られるマススペクトルは同位体組成の異なる分子のそれぞれの質量情報を理論値と比較するため、原子量や分子量といった平均にならされた情報はあまり参考になりません。そのため、質量分析で得られた実測値を理論値と比較する場合には、平均値ではないモノアイソトピック質量が重要となります。
| 用語 | 意味 |
|---|---|
| モノアイソトピック質量 |
|
| モストアバンダント質量 |
|
| ノミナル質量 |
|
| 平均質量 |
|
| 原子量 = 相対原子質量 |
|
| 分子量 = 相対原子質量 |
|
| モル質量 |
注)従来のアボガドロ定数は「0.012 kgの12Cのなかに含まれる原子の数」とされていたが、2019年のSI基本単位の再定義により現在のアボガドロ定数は「6.022 140 76 × 1023 mol-1」となった。 |
| 統一原子質量単位 |
|
1.3.6. 多価イオンとは
LC-MSでは電荷数 (z) が1より大きいイオンが生じることがあり、これは多価イオンと呼ばれます。電荷数が大きくなれば m/z の値は小さくなるため、1価 (つまり電荷数が1の場合) では m/z の上限値を超える大きな質量の化合物であっても、多価イオンが生成されれば分析が可能となります。
多価イオンを生成する化合物では、電荷数が異なる多価イオンが複数生成されることがあります。その場合、単一成分であっても、同位体とは別に複数の多価イオンのスペクトルが観測されることがあります。ウマミオグロビンをLC-MSで分析した例を見ますと、10価から20価までの多価イオンを観察することができます。
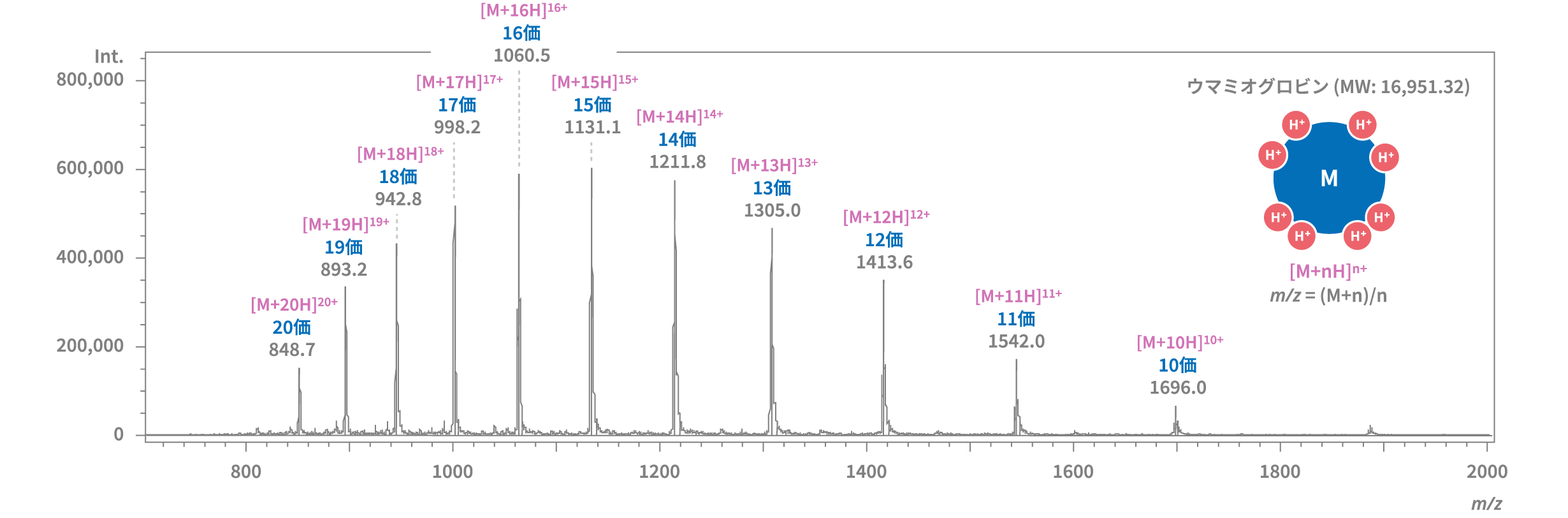
複数の多価イオンが観察されると、隣接する多価イオンの m/z A および B (A<B)より、B/(B-A) の式を用いて m/z Aの価数nを求めることができます。m/z 1131.1 (A) と1211.8 (B) に着目すると、m/z 1131.1は15価のイオン [M+15H]15+ であることがわかります。
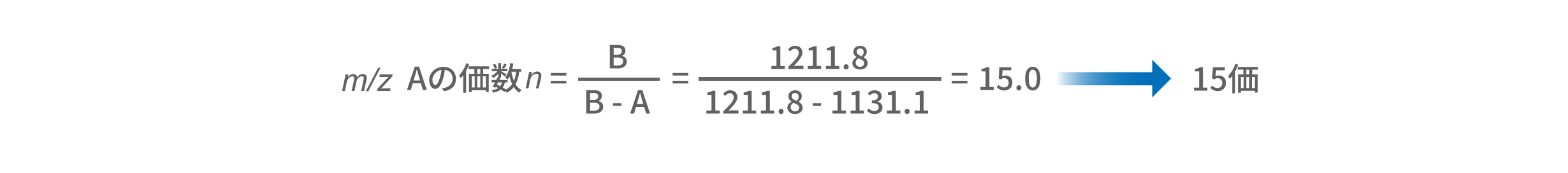
また、価数がわかれば、m/z の値と価数nから、分子の質量も求めることができます。m/z 1131.1 (A) は15価のイオンなので、分子の質量はおよそ16951.5となります。
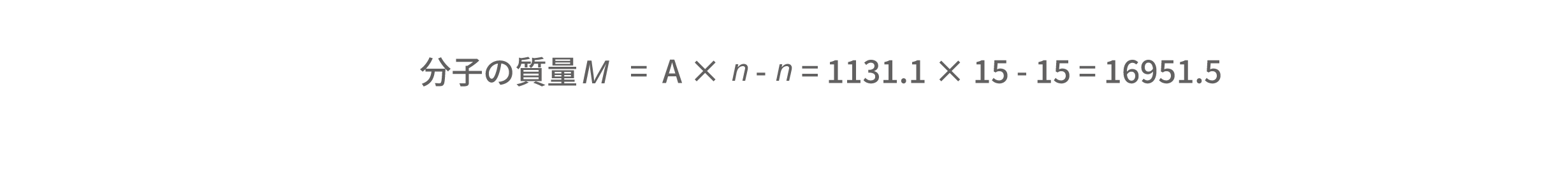
このように、多価イオンの m/z から分子の質量を求める計算をデコンボリューションと呼びます。デコンボリューションを行うソフトウェアでは、すべての隣接するイオンピークの計算を行い、イオン強度に応じて重み付けをして計算結果を出しています。
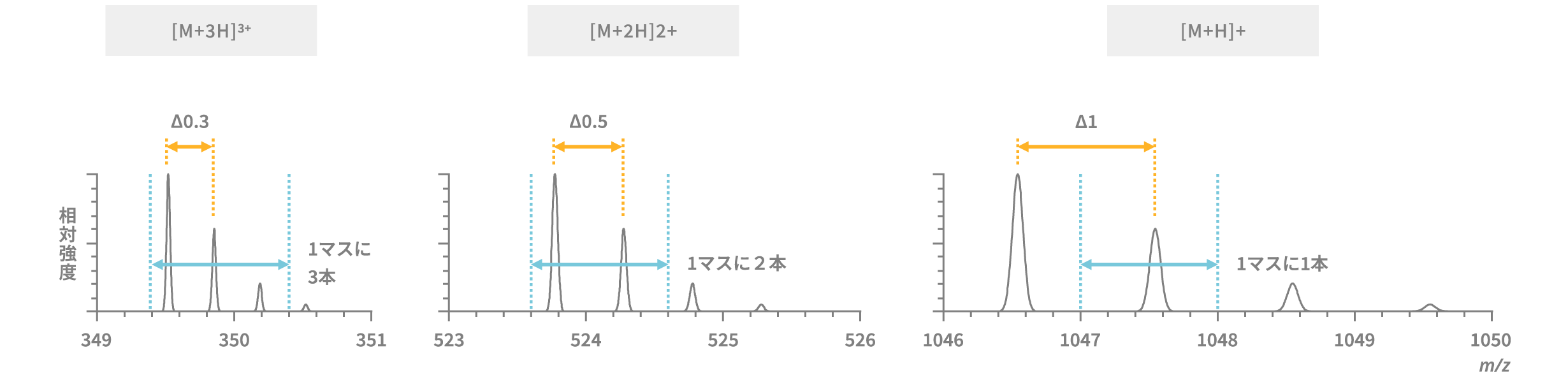
コラム「1マスに同位体ピークが何本あるか」
低分解能のMSでは多価イオンの同位体イオンピークは分離できないため、多価イオンの m/z はモストアバンダント質量に近い値が観察されます。一方、高分解能のMSでは多価イオンにおいても同位体ごとの質量を測定することができます。このことから、同位体イオンピークどうしの m/z の差からそのイオンの価数を決定することができます。
1価のイオンなら、イオンの質量は1で割られるため同位体イオンピークの差は1 uとなります。2価のイオンなら、イオンの質量は2で割られるため同位体イオンピークの差は0.5 uとなります。3価のイオンなら、イオンの質量は3で割られるため同位体イオンピークの差は0.3 uとなります。このように1マスの間に同位体イオンピークが何本あるか数えることによって、そのイオンの価数を判断することができます。