糖類の分離法
糖類は自然界にもっとも広く、多量に存在する有機化合物群のひとつであり、その種類は単糖、オリゴ糖から多糖、中性糖、酸性糖、アミノ糖、糖アルコール、さらにそれらの異性体等々多岐に渡ります。
これら糖類の分離分析にはHPLCが広く用いられていますが、分析にあたっては目的に応じて適切な分離法や検出法を選択する必要があります。今回は、この内分離法(主に中性糖)についてのお話です。
糖とは
糖は一般に炭素、水素および酸素から構成され、ケトン基またはアルデヒド基を有しています。栄養学においては炭水化物(Carbohydrate)として定義されており、この炭水化物はさらに消化される糖類と消化されない糖類(食物繊維)等に大別されます。消化される糖は下記特徴により多種多様に存在します。
・幅広い分子量・・・単糖、オリゴ糖、多糖
・多くの異性体・・・Enantiomer、Diastereomer (Epimer)、Anomer
・酸性から塩基性・・・ウロン酸、中性糖、糖アルコール、アミノ糖
分離方法の種類
糖類は親水性が高いため、逆相クロマトグラフィーが使用できないという問題点があります。この問題点を考慮して、それぞれ異なった作用に基づき糖を分離する方法があります。代表的なモードとして以下の5種類があり、対象成分に応じて適切な分離方法を選択します。
■サイズ排除・・・・・・・・・・・・・・・・分子の大きさ
■配位子交換・・・・・・・・・・・・・・・・金属対イオンとの錯形成力
■親水性相互作用・・・・・・・・・・・・固定相(水相)への分配力
■陰イオン交換・・・・・・・・・・・・・・陰イオン交換力
■ほう酸錯体陰イオン交換・・・・ほう酸との錯体の陰イオン交換力
(ただし、これらのモードが複数関与する場合もあります)
サイズ排除
糖類を分子量により分離したい場合に用います。数百から数百万分子量に渡る分子量分布がわかります。基本的には分子サイズによる分離ですので、同一分子量の成分は分離できません。
充てん剤としては親水性ポリマーが用いられ、通常移動相には水のみを用います。しかし、イオン性成分などでは、充てん剤と相互作用が起こるため、移動相に塩類を添加することもあります。
-
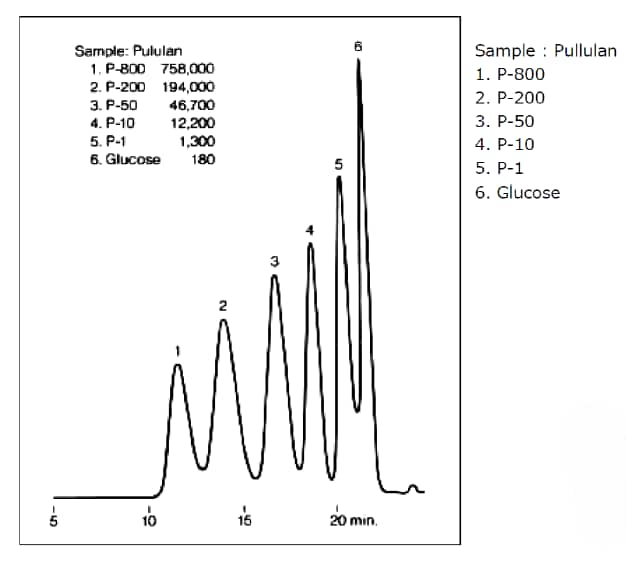
サイズ排除クロマトグラフィーによるプルランの分離
-
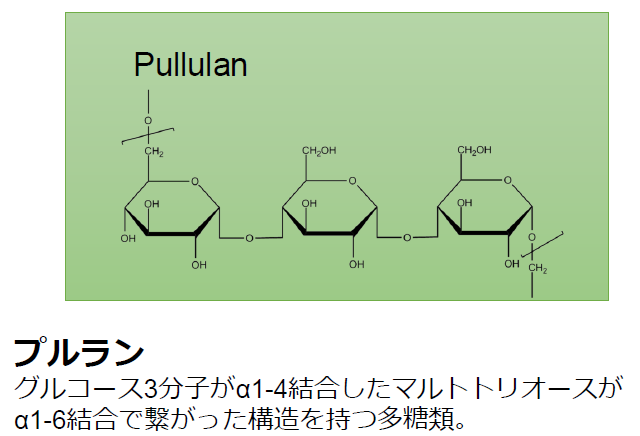
配位子交換
配位子交換モードでは、カラム内の充填剤としてスルホン化ポリスチレンゲルが使用されており、そこに金属イオン(Na+、Ca2+、Pb2+など)が対イオンとして結合しています。これらの金属イオンは、糖類が持つ水酸基(–OH)と錯体を形成することで、糖の保持時間に違いが生じ、分離が可能になります。
この方法は、特に単糖や二糖など分子量1000以下の糖類の分離に適しており、基本的には排除限界分子量約1000のサイズ排除クロマトグラフィー(SEC)の原理をベースとしています。しかし、同じ分子量の糖類であっても、水酸基の位置や数、そして使用する金属イオンの種類によって錯体の安定性が異なるため、保持時間に差が生じます。
糖類の保持は、糖が金属イオンの水和水と置き換わって形成される錯体の安定性に強く依存しており、これが分離の鍵となります。
ナトリウム型(Na+)、カルシウム型(Ca2+)、鉛型(Pb2+)のそれぞれの金属イオンと水和水との錯体の形成の強さおよび安定性は、Na+<Ca2+<Pb2+の順になります。
Na型では、錯体形成が弱く、ほとんどサイズ排除作用が働くため、グルコースとフルクトースが分離できる程度ですが、Ca型では水和物との錯体形成により、糖アルコールが選択的に保持され、Pb型では錯体形成能が非常に強いため、糖アルコールの保持がさらに強くなり、一部単糖類相互分離も良くなります。
この方法で用いる移動相は水だけですので、環境にやさしい分離法と言えますが、逆に移動相による分離のコントロールはできません。
また、2糖類の相互分離が困難、Ca型やPb型ではカラム温度を80℃程度に設定する必要がある(アノマー分離によるピークの割れや崩れを防ぐため)点など注意が必要です。
| 錯体形成能 | 分析時間の長さ | 単糖同士の分離 | 糖アルコールとの分離 | |
|---|---|---|---|---|
| Na型 | △ | ◎ | △ | ✕ |
| Ca型 | 〇 | 〇 | 〇 | 〇 |
| Pb型 | ◎ | △ | ◎ | ◎ |
各充填剤の分離時間、分離の対照表
固定相としてCa型のスルホン化ポリスチレンゲルを使用した、Shim-pack SCR-101Cを用いてグルコースの異性体を分析した例を下記に示します。
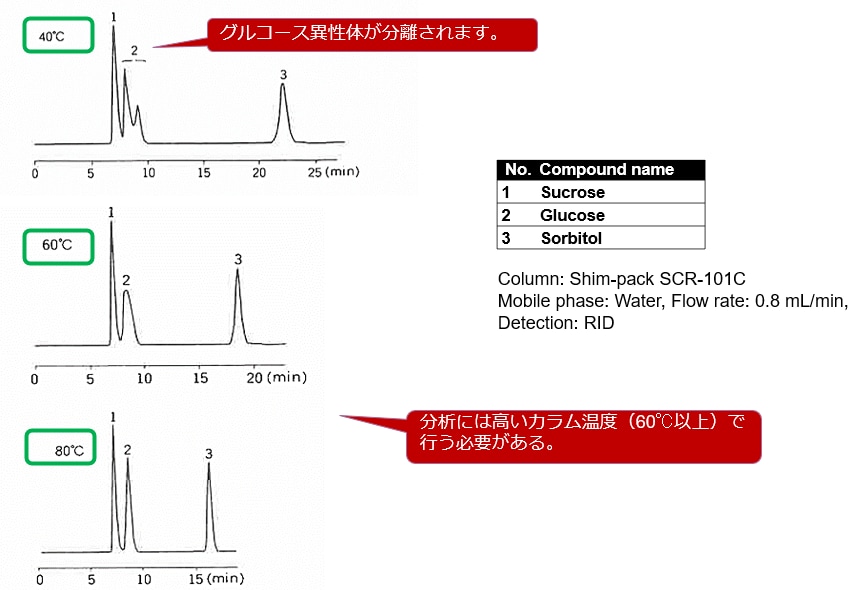
各カラム温度での分離の違い
親水性相互作用
親水性相互作用クロマトグラフィーの固定相には、一般的にシリカゲルやポリマーの担体にアミノプロピル基やアミド基などの極性基を結合させた充てん剤が用いられます。移動相には水とアセトニトリルの混合液が用いられ、カラムの表面に形成された水の層(静的水相)と、分析対象の糖が親水性相互作用(主に水素結合や双極子相互作用)を起こします。糖の極性が高いほどこの水層に強く保持され、溶出が遅くなります。
親水性相互作用クロマトグラフィーでは、単糖類からオリゴ糖までの分離に適しています。特に、オリゴ糖構成糖の1個1個の違いを識別することができますので、2糖類の相互分離も容易です。またグラジエント溶離が可能であるため、効率良く多成分一斉分析に適用できます。なお、固定相のアミノ基は糖類のアルデヒド基と反応してシッフ塩基を作りますので、特に五単糖(アラビノース、リボース等)ではピークが大きくテーリングすることがあります。これは、移動相に塩を添加することにより抑制することができます。また、単糖同士の相互分離には限界がありますのでご注意ください。
分離カラムの官能基にアミノ基をもつ、Shim-pack GISTを用い、単糖および二糖類を分析した例を下記に示します。

陰イオン交換
中性糖のpKaは12程度ですから、強塩基性移動相では陰イオン交換樹脂に保持させることができます。この場合、移動相としては0.1M程度の水酸化ナトリウム溶液が用いられます。
一般に、単糖類からオリゴ糖の順に溶出します。水酸化ナトリウム濃度を変化させるグラジエント法と組み合わせますと、多成分の一斉分離が可能となります。
ほう酸錯体陰イオン交換法
糖類のようなポリオキシ化合物は、ほう酸やほう酸塩と速やかに反応して負電荷をもつ錯体を形成します。つまり、移動相にほう酸緩衝液を用いると、糖類を陰イオン交換で分離することが可能となります。
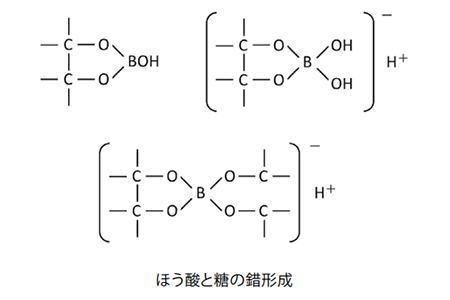
この方法は、単糖から2糖類の相互分離に優れた方法です。特にほう酸緩衝液の濃度とpHを変化させるグラジエント法により、多成分を効率良く分離することができます。
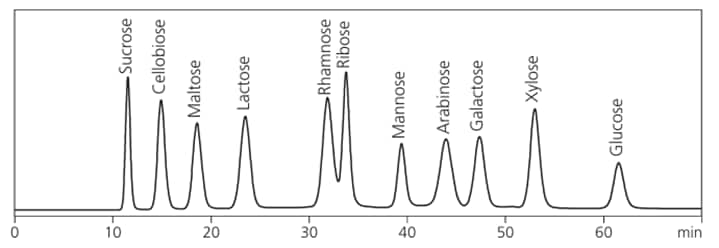
カラム: Shim-pack ISA-09
ガードカラム: Shim-pack ISA-09(G)
移動相(グラジエント)
A) 0.1 mol/L ほう酸カリウムバッファー(pH8.0)
B) 0.4 mol/L ほう酸カリウムバッファー(pH9.0)
流量: 0.6 mL/min
カラム温度: 65 ℃
反応液: 30 g/L 含有ほう酸水溶液
10 g/L L-アルギニン
検出器: FLD(Ex: 320 nm,Em: 430 nm)
糖の分離方法のまとめ
| 分離方法 | 単糖 | オリゴ糖 | 多糖 |
|---|---|---|---|
| サイズ排除 | ✕ | ✕ | ◎ |
| 配位子交換 | ◎ | ✕ | ✕ |
| 分配(親水性相互作用) | 〇 | ◎ | ✕ |
| 陰イオン交換 | ◎ | 〇 | ✕ |
以上、糖類の分離は案外と難しいものです。目的成分と夾雑成分を考慮して、最適な分離モードを選ぶ必要があります。


