
LC分析の留意点

中山 聡 先生
味の素株式会社 バイオ・ファイン研究所 (ご所属・役職は2019年4月発行時)
1994年に東京大学薬学系研究科修士課程卒業後,味の素株式会社に入社。医薬品開発の分析業務(薬物動態、規格設計)に20年ほど従事。2016年よりアミノ酸類の精密メタボロミクスや無機分析など定量を主業務とするグループのマネージャーに従事し,現在に至る。
【専門分野】クロマトグラフィー,Regulated Bioanalysis
【将来の夢】気ままな国内外への旅行
【趣 味】テニス,スナップ写真
■私たちのグループでは,アミノ酸やその関連物質を中心とした生体代謝物の測定を主要業務の一つとして行っています。いわゆるメタボロームに属する内容ですが,一般的なメタボローム研究とは少し異なるアプローチをしています。私たちが開発している分析法では測定ターゲットはせいぜい20~40程度と少なく,1サイクルも15~30分と今どきの測定方法としては少し長めです。血液検体中のアミノ酸濃度が疾患により変動することは古くから知られていますが,先天性代謝異常を除けばその変動はあまり大きくありません。そのわずかな変動を捉えるため,精確性(真度+精度+再現性)を優先した測定を行っているわけです。特に血漿中遊離アミノ酸については,採血から測定まで標準化された分析法1)を多くの共同研究者とともに開発し,医薬品開発の世界のスタンダードとなっているBMV(Bioanalysis Method Validation)ガイドライン2)を上回る基準で管理・運用をしています。
■BMVガイドラインの基準である「真度100±15 %,精度15 %以内」というのは,医薬品開発で要求される精確性と日常の管理の手間のバランスがとられており,ある意味運用しやすい基準です。この基準より厳しい管理をするとなると,注意を払わなければいけない事項が飛躍的に増えます。標準品の品質,前処理操作,試料の安定性などはもちろん,使っている容器の形状や材質まで幅広く管理を行うことが求められます。分析的に取り扱いやすく,生体内代謝物としては存在量も多いアミノ酸ですら測定に際しては多くのトラップ(注意ポイント)があります。
■その中でも,測定装置/測定法の堅牢性は重要な要素の一つとなります。私たちはヒト血漿中の遊離アミノ酸濃度を(株)島津製作所と共同開発した自動プレカラム誘導体化機能付LC/MS装置「UF-Amino Station」を用いて測定しています。
(株)島津製作所の開発陣の英知が詰まったシステムではありますが,「プレカラム誘導体化」「多成分(数10種のアミノ酸)分離」「MS検出」など変動要因の多い装置/測定法をBMVガイドラインの基準を上回るレベルで運用しているわけですので,装置状態には常に神経を尖らせています。10年近くシステムを運用しノウハウも蓄積してきましたので,現在では部品の経年劣化以外のトラブルはほとんど発生しない状態で稼働しています。このノウハウは装置点検を行っている(株)島津アクセスの協力も得て昨年末にマニュアル化されており,装置を使用していただく研究者の方々に活用いただけるようになっています。また,装置の課題についても開発陣の方々と議論をさせていただいていますので,今後一層堅牢性が高い装置の開発が期待されます。日頃お世話になっている(株)島津製作所,及び,(株)島津アクセスの方々に紙面を借りて御礼申し上げたいと思います。
■メタボローム研究において分析の精確性が重要であるということは,測定の実務を行っている研究者にとっては共通の問題意識となっているのではないかと思います。「生体内代謝物の濃度はコントロールされていて疾患等による変動幅が思ったよりも大きくない」というのは,アミノ酸に限った話ではありません。網羅的に数100~1000の代謝物を一斉に高速分析できたとしても,その精確性が悪ければ微小な変動を捉えることはできません。私たちが測定ターゲットを絞り,分析時間も長めにすることで,選択性を上げ,マトリックス効果の軽減に努めている理由はここにあります。この考え方は,測定化合物群を絞り込む「ターゲットメタボロミクス」という研究の方向性と合致しており,近年は評価されつつあるように感じています。ただ,分析の精確性の良さというのはどうしても目新しさに欠けるようで,論文上で理解してもらうのはとても難しいようです。レビュアーのコメントを見るたびに,分析の「質」を感覚的に表現できる手法の必要性を感じています。きっと,私たちクロマト研究者に課せられた課題なのだと思っています。
■そんな評価を受けながらも,苦労して論文投稿した分析法を一つ紹介したいと思います。軸不斉骨格を有する新規キラル誘導体化試薬 (R)-BiACを用いたD,L-アミノ酸分析法です。LC-MS/MSを用いて,タンパク質構成アミノ酸19種類を分離度1.9以上でキラル分割することができます。19種全てのD-アミノ酸がL-アミノ酸よりも前に溶出するように設計されており,100倍以上の濃度差があっても微量のD-アミノ酸を捉えることが可能です。この性能を持って,1サイクルは約15分。わかる人にはわかってもらえる「高速分析法」です(図1)。
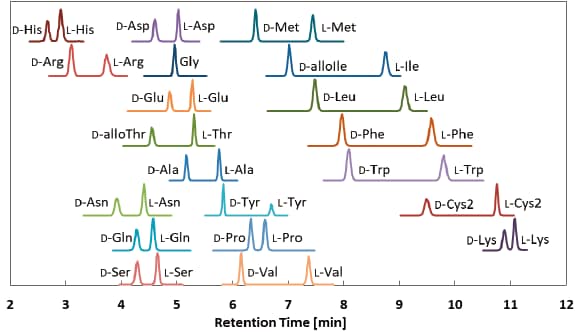
図1 (R)-BiAC試薬を用いたD,L-アミノ酸のクロマトグラム
■本試薬はLC-MS用に設計されており,MS感度を向上させる官能基をもたせることで1インジェクションあたりattoモルレベルでの高感度を達成しています3)(図2)。
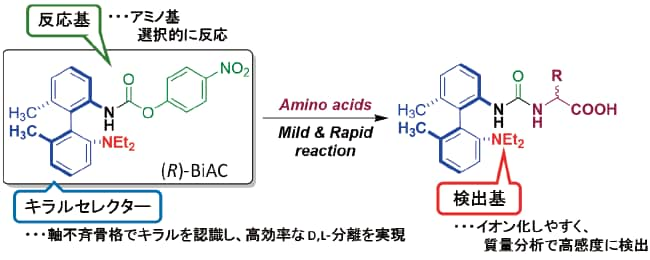
図2 (R)-BiAC試薬の設計コンセプトとアミノ酸との反応
■実際のD,L-アミノ酸測定ではキラル分割だけでなく,ロイシン,イソロイシンなど同じ質量をもつ他のアミノ酸類との分離も重要なポイントです。また,キラル分離では準備できる安定同位体ラベルの内標準物質に限りがあることから,マトリックス効果の影響を最小限にするためにも保持時間の再現性が必要となります。一般に,分析時間が短くなるほどナーバスな装置設定が要求され,分離や保持時間を一定に保つことが難しくなります。私たちの研究目的である「精密メタボロミクス」の特徴を出すためには,これ以上の高速化はまだまだ難しいようです。
D,L-アミノ酸分析は日本のチームの研究が先導しており,高い選択性を有する多次元分析法(九州大学)や誘導体なしで簡易的に測定ができるキラルカラムLC-MS法(大阪大学)など優れた分析法が開発されD-アミノ酸研究が広がってきています。私たちも自身の分析法の特徴を生かして,D-アミノ酸研究の世界を切り開いていきたいと思っています。
参考文献