pKaと解離平衡
1. pH
塩酸などの酸を水に加えると,pH が下がります。 溶液の酸性度はプロトン(水素イオン)の濃度([H+])によって決まりますが,pHは[H+]を簡単に表現するための指標です。 pHは次式のように表されるので,酸性が強い(プロトン濃度が高い)程小さな値となります。
![]()
pHについて注意が必要なことは,pHが1だけ変化したとき,プロトン濃度は10倍変化することです。
注)濃度ではなく活量を使用する必要がありますが,分析濃度では濃度と活量がよく対応するので,簡単のため活量の代わりに濃度を使用しました。(以下同様)
2. pKaと解離平衡
さて,酸の中には水に溶かしたときすべて解離するもの(強酸)と一部しか解離しないもの(弱酸)があります。 酸が解離するとプロトンを放出して溶液を酸性化しますが,弱酸の場合次式のような解離平衡式に従って解離状態(A-),非解離状態(AH)が共存します。
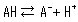
両辺の濃度の比は一定条件下では定数となり,酸解離定数(Ka)と呼ばれます。 Kaの定義式は次式の通りです。
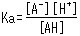
式中[ ]は各成分の濃度を表します。 この式から,その酸のプロトンの放出し易さ(すなわち酸としての強さ)はKaによって表され,また弱酸の解離状態は溶液中の[H+]によって変化することがわかります。
さて,酢酸や乳酸のようなカルボン酸(-COOHを持つ酸)は通常10-3~10-6程度のKaを持ちますので,Kaのままで取り扱うと,表現がややこしく,直感的にわかりにくいという問題が生じます。
そこで,弱酸の強さを表現するためにpKaという指標を導入します。 pKaの定義式は次式のようになります。
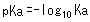
例えば酢酸(CH3COOH)のKa は0.0000158(=10-4.8)となりますが,これをpKaで表すと,4.8と簡単に表現できます。 またpKaが小さい程,強い酸であるということになります。 例えば,乳酸のpKaは約3.8ですから,乳酸の方が酢酸より強い酸だということになります。
3. pKaと緩衝能
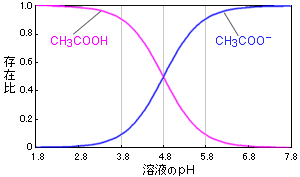 図.溶液のpHと酢酸の解離状態の関係
図.溶液のpHと酢酸の解離状態の関係そして,もう一つ重要なことは溶液のpHと酸のpKaとの関係です。 この関係式は次式の通りです。
![]()
これを変形すると,次式のようにあらわせます。
![]()
この式は,pKaとpHが等しいとき,その酸はちょうど半分だけ解離している([A-]/[AH]=1)ことを示します。 そして,pKaの付近でpHが1だけ変化すると,その酸の解離状態は,非常に大きく変化します。
例えば酢酸の場合,溶液のpHが4.8付近で変化すると酢酸の存在状態は図のように大きく変わります。 pHが3.8のときには90%以上が酢酸(CH3COOH)の状態だったのが,pH5.8のときには酢酸イオン(CH3COO-)の状態で90%以上存在していることになります。
逆に考えると,酸のpKa付近でpHを変化させるには,その酸の解離状態を大きく変化させねばならず,非常に多くの酸または塩基が必要だということになります。 このような溶液のpHを維持する性質を,その溶液の緩衝能と言い,緩衝能はpKaとpHが近い程大きくなります。 LCでも多用される緩衝液の選択の際に,目的のpHに近いpKaをもつ酸・塩基を緩衝液として選ぶのはこの緩衝能を生かすためなのです。



