1.1. 質量とは ?
1.1.1. 物質の質量
水 → 水分子 H2O → O 原子 + H 原子
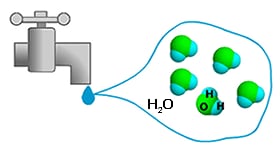
物質は多くの分子で構成されています。分子は物質の化学的性質を決定する最小単位です。 同様に,分子はさらに原子(元素)から構成されています。現在,自然界には約110種類の原子が存在していることが知られています。例えば,水分子 H2O は2個の水素 (H) 原子と1個の酸素 (O) 原子から成り立っています。
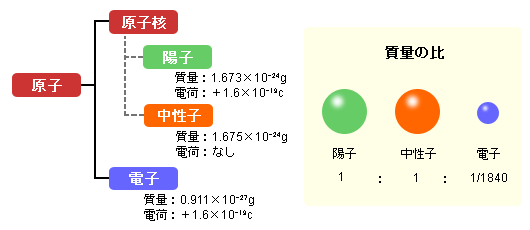
原子の芯は原子核と呼ばれています。原子核は正の電荷を持つ粒子;陽子と電気的に中性な粒子;中性子から構成されています。原子は,他に,電子と呼ばれる負の電荷を持つ粒子が含まれています。原子核を取り巻く電子の個数は陽子の個数と同じだけ存在します。
陽子と中性子の質量はほぼ同じですが,電子の質量は陽子の質量の約 1/1840 しかありません。従って,原子や分子の質量は,ほぼ,陽子と中性子の総数で決定されるといえます。
1.1.2. 質量数と同位体
質量数
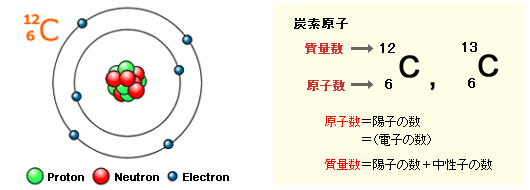
原子の質量の大部分は,陽子と中性子からなる原子核が担っています。陽子数と中性子数の和を質量数といいます。したがって,質量数は原子や分子の質量を近似したものといえます。
一方,原子に含まれる陽子の数を原子数といいます。原子数は原子(元素)の化学的性質を決定します。
同位体
同位体は,同じ陽子数,異なった中性子数からなる原子のことをいいます。同位体はそれぞれ同じ化学的性質を持っていますが,質量数が異なっています。
炭素原子には2つの同位体があります:12C と13C。2つの原子は同じ原子数6を持つので同じ化学的性質を持ちます。しかし,13Cは中性子を1つ多く持っているので,13Cの質量は12Cより大きな質量をもっています。
1.1.3. 炭素原子の同位体存在度
実験結果によると,地球上に存在する自然同位体の存在比率は一定です。各原子の自然同位体の比率を同位体存在度といいます。
炭素原子の場合,自然界には2種類の安定な同位体が存在します。もっとも多く存在する同位体は12Cで,13Cは12Cの約1%存在します。
| 12C | 13C | |
| 質量数 | 12 | 13 |
| 相対存在比(%) | 100 | 1.08 |
1.1.4. 同位体存在度表
この表はGCMS分析で重要な原子の自然同位体の存在度を示したものです。 Aはもっとも多く存在する同位体を示しています。HやC にはA+2 の同位体は存在しません。一方,Cl やBrはA+1の同位体は存在しませんが,A+2の同位体の存在度は,比較的大きくなっています。例えば,HCl を分析すると,これに対応して, m/z=36と38の2つの大きな分子イオンピークが観測され,その比率は約3:1になります。F,PやI 原子はひとつの同位体しか存在しません。
相対的存在度はマススペクトルに反映されます。従って,スペクトルのパターンからどの原子が何個,分子中に存在しているかが推測できることがあります。
| Element(A) | Element(A+1) | Element(A+2) | |||
| 1H | 100% | 2H | 0.012% | - | - |
| 12C | 100% | 13C | 1.08% | - | - |
| 14N | 100% | 15N | 0.37% | - | - |
| 16O | 100% | 17O | 0.037% | 18O | 0.2% |
| 28Si | 100% | 29Si | 5.1% | 30Si | 3.3% |
| 32S | 100% | 33S | 0.8% | 34S | 4.5% |
| 35Cl | 100% | - | - | 37Cl | 32.0% |
| 79Br | 100% | - | - | 81Br | 97.3% |
| 19F | 100% | - | - | - | - |
| 31P | 100% | - | - | - | - |
| 127I | 100% | - | - | - | - |
1.1.5. 分子量
原子質量単位(u) は原子や分子の質量を表すのに使用します。1uは12C 原子の質量の1/12の質量として定義されます。この単位を用いると1H 原子の質量は1.0078uになります。
分子量は分子を構成する原子の原子量と分子式から計算できます。
単位質量の分解能しかもたない質量分析器のマススペクトルで,例えば,m/z=28のところにピークが観測されても,すぐに,このピークの同定はできません。エチレンC2H4, 一酸化炭素COまたは窒素N2の可能性があるからです。これをきちんと同定するには精密質量の分析ができる磁場型のような高分解の質量分析器が必要となります。
| 原子質量単位の定義 炭素同位体12Cの質量 = 12.000 u |
| 原子量の例 | 分子量の例 | ||||||||||||||||
|
|


