光とは何か
紫外可視近赤外(UV-Vis-NIR) 分光光度計
「光は波か?粒子か?」という問題は歴史的に様々に議論されてきました。 ニュートンは「光は粒子である」と主張し,一方ホイヘンスは「光は波である」として理論を展開したことは有名です。 現代物理では光は波であると同時に粒子としての性質も合わせ持っていることがわかっています。 本稿では光の二面性と物質による光の吸収に関して解説します。
1. 光の二面性
(1)光の波動性
「光は波である」と一般に言われますが,光は水面に起る波のように媒質を必要としません。 図1のように,真空中を電場と磁場が垂直に絡まりあいながら進行していくものが光です。 電場または磁場の波形の山から山の長さが波長となります。
![]()
光を扱うと,干渉や回折などの波特有の現象が表れます。 光が干渉することを発見し,光が波であることを決定づけたヤングの実験は有名です。 図2のように光源Lから出た単色光は単スリットを通過し,その後,二本のスリットS1,S2を通過します。 後ろのスクリーン上には明暗の縞模様が観測されます。 これはスリットS1,S2をそれぞれ位相の合った光源と考え,ここから波が伝わって後ろのスクリーン上で二つの波の位相が合うところで強め合い,合わないところで弱め合うと考えるとよく説明されます。 紙面を水面,スリットを穴の開いたついたてと考え,左から右へ波を進行させると,類似の現象が起こることより,ヤングの実験は光が波の性質をもつことを直感的に示してくれます。 ちなみに紫外可視分光光度計で使用されるグレーティング(回折格子)は,単色光を作り出すときに,光が回折し,干渉をするという波特有の性質を利用しています。
![]()
光は電磁波の一種であり,電磁波は波長によって図3に示すように異なる呼び名が与えられています。 光というと一般的には赤外線から紫外線までの電磁波を示しますが,可視光線だけを示す場合もあります。 凡そ400nm~800nmの波長の光を可視光線と呼び,私たち人間が実際に見ることのできる光となっています。 例えば470nmの光は青色,540nmの光は緑色,また650nmは赤色となります。 人間が“見ることができる”電磁波ということで,私たちにとって特別に親しみのある光は可視光であると言えるでしょう。
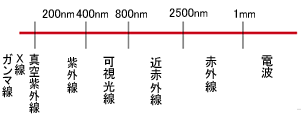
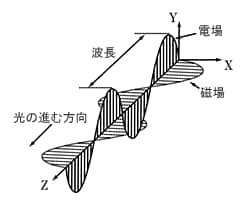
図1 光の電場と磁場の様子1)
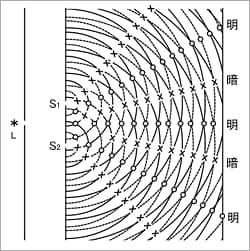
図2 ヤングの実験2)
(2)光の粒子性 次に,粒子としての側面を見てみましょう。 光が粒子性をもつことを決定づけたものに19世紀後半から20世紀初頭に行われた光電効果の実験があります。波としての性質では説明がつかず,光を粒子としてとらえるとうまく実験結果が説明されます。 粒子的な側面を強調すると,光を“光子”と呼びます。
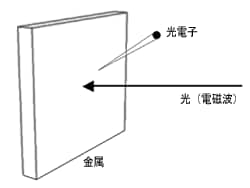
図4 光電効果の概念図3)
図4に光電効果の概念図を示します。 光電効果とは,金属に光を当てたときに,金属の表面から電子が飛び出す現象です。 飛び出した電子を光電子と呼びます。 強い光を金属に当てても電子は飛び出さないのに,波長の短い光を当てると電子が飛び出します。 また,当てる光の波長を短くすると,飛び出す電子の数は変わらず,電子のエネルギーが大きくなります。 光を強くしていくと,飛び出す電子の数が増え,電子のエネルギーは変わりません。 これらの現象は,光が波動であるとした場合には説明がつかず,光を粒子としてとらえ,この粒子が金属に当って,電子がはじき出されると考えると説明することができます。 コンプトン効果の実験など他の実験も加わって,光は粒子性をもつことが認められるようになりました。 なお,紫外可視分光光度計の検出器として用いられる光電子増倍管は,光電効果を利用して光を検出しています。 以上より,光は波と粒子の二面性をもつことを説明しました。 相反する二つの性質をもつというのは,一見不思議なことですが,これが現代物理がとらえる光の姿です。
2. 物質による光の吸収
光を物質に照射することにより,その物質に関する様々な情報を取り出すことができます。 紫外可視分光光度計では紫外線や可視光線を照射して,物質の電子の情報を得ることができ,さらにはその物質の量を測ることができます。
物質による光の吸収を考えます。 これは量子力学と密接に関係しています。 量子力学は,20世紀初頭に作られた理論で現代物理の支柱の一つとなっています。 量子力学はニュートン力学と対比するとわかりやすく理解することができます。 大雑把に表現すれば,ニュートン力学は大きな粒子の運動を扱い,量子力学は小さな粒子(原子,分子など)の運動を扱う理論です。 ニュートン力学は粒子の運動を“連続的なもの”として扱いますが,量子力学では小さな粒子は“不連続な運動状態(エネルギー)をとる”ことを主張します。 ニュートン力学全盛の当時にあってこれは信じ難いものでしたが,徐々に証明されていきました。
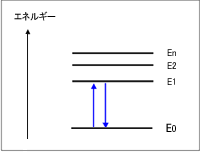
図5 エネルギー準位
原子中の電子に関する量子力学の方程式を解くと,図5のように電子のエネルギー状態がとびとびとなります。 E0を基底状態,E1,E2,・・を励起状態と呼びます。 電子がE0からE1のエネルギー状態へとび移るためには,(E1-E0)のエネルギーをもつ光が電子にぶつからなければなりません。 これが光の“吸収”という現象です。 電子は固有のエネルギー準位をもっており,紫外線・可視光線は電子のエネルギー状態を変化させるエネルギーをもっています。
![]()
高いエネルギー状態E1は不安定であるためすぐに基底状態E0に戻ります。 E1からE0に戻る際に放出されるエネルギー(E1-E0)は熱に転化されます。 もし熱に転化されない場合は,光として放出されますが,光の放出現象は蛍光やりん光としてよく知られています。![]()
分光分析における定量測定の関連で述べますと,溶液中に目的分子がたくさんあれば吸収が大きく出ますし,少なければ吸収は小さく出ます。 吸収の大小で物質の量すなわち濃度を測ることが定量測定の基本的な考え方となります。
![]()
横軸を波長,縦軸を吸収の大きさとしてグラフ化したものを吸収スペクトルと呼びます。 吸収の大きさは,吸光度(Abs)という単位で表されます。 図6は島津紫外可視分光光度計UV-2550(図7)で測定したβ-カロチン溶液の吸収スペクトルです。 β-カロチンは人参の色を決定する主要素となっています。 図6に示すのように400nm~500nmの青・紫の光を主に吸収しています。 可視光の中で残った緑・赤の光の混合色光が人間の目に届くためにβ-カロチンを多く含む人参は黄・赤色に見えることになります。
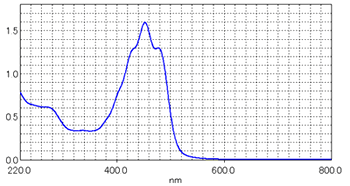
図6 β-カロチンの吸収スペクトル

図7 紫外可視分光光度計 UV-2550
3.最後に
今回は光の性質と吸収という紫外可視分光光度計の基礎となるところを解説しました。 分光分析という観点から見ると紫外可視分光光度計以外にも赤外分光光度計,原子吸光光度計,ラマン分光光度計,蛍光分光光度計など多種多様な分光計測機器があり,それぞれ特徴ある分析を行います。 これらを使い分けることで試料の様々な情報を異なった側面から取り出していくことができます。 次回からは紫外可視分光光度計の構造に関して解説していきます。
1)木骨寛治:光をはかる,10章(照明学会編,日本理工出版会,1993年)p.172
2)原島鮮:初等量子力学(裳華房,1987年)p.3
3)阿部龍蔵:量子力学入門(岩波書店,1987年)p.31


