|
近年,抗癌剤などの用途で,急速に普及しつつあるバイオ医薬品は基本的にはタンパク質であり,このバイオ医薬品中に100nm~10μm程度の大きさの凝集体が含まれていると,人体に重篤な副作用を引き起こす危険性が懸念されています。
しかし,現状では明確な規制はなく,この粒子径範囲の濃度を正確に測定できる技術も確立されていない状況です。
温度や機械的ストレスがタンパク質を凝集させる要因になると考えられており,それらの影響をバイオ医薬品開発の初期段階で吟味し,凝集しにくい安定なタンパク質を原材料として選択する必要があります。
qLD法を用いると個数濃度として粒子径分布を評価することができるので,凝集体の発生量の大小を評価することができます,また,温度や機械的ストレスの条件下で,凝集体の濃度の時間的変化を観察することができるのでバイオ医薬品に用いるタンパク質の安定性に関するスクリーニングを効率的に行うことができます。
ここではその測定例を紹介します。
本実験で用いたサンプルはウシガンマグロブリン(G5009, シグマアルドリッチ製)で,サンプルをリン酸バッファ (pH7.4, NaCl 150mM)に投入し,1 mg/mL に濃度調製を行った溶液を使用しました。測定にはqLD法を採用した島津バイオ医薬品凝集性評価システムAggregates Sizerを使用しています。光源は波長405nmの青紫色半導体レーザであり,30秒間隔での連続測定が可能です。
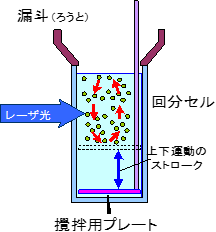
図4 回分セル
本実験においては,図4に構造を示す回分セルに5 mlのサンプル分散液を投入して測定を行いました。この回分セルでは図に示すように撹拌プレートの上下運動でサンプルに機械的ストレスを加えながら粒子径分布を測定することができます。今回の実験では,回分セル内の凝集体の個数濃度の時間的変化を5分ごとに測定し最大40分までの変化を観察しました。その結果を図5および図6に示しています。
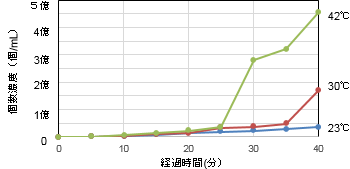
図5 粒子径区間(0.2~2μm)における凝集体の個数濃度の変化
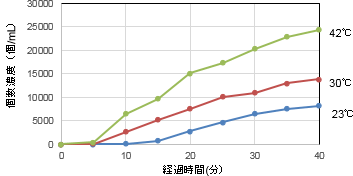
図6 粒子径区間(2~10μm)における凝集体の個数濃度の変化
温度条件は23℃,30℃,42℃の3種類とし,撹拌プレートの材質はPEEK(ポリエーテルエーテルケトン樹脂)製を用いています。
図5および図6は、ぞれぞれ、粒子径区間0.2~2μmおよび粒子径区間2~10μmの範囲に存在する凝集体の総数の変化を個数濃度の変化として示しています。図には同じ条件で3回の実験を行い、その平均値と標準誤差を表示しています。
0.2~2μmの範囲では、42℃の条件で、25分経過以降に凝集体の個数濃度が急速に増加し、30℃の条件でも30分経過以降に増加がみられます。しかし23度の条件下では凝集体の発生は少ない。このように、凝集体の発生状況には顕著な温度依存性が現れ、40分経過42℃では約4億5000万個/mLの凝集体が発生しています。 2~10μmの凝集体の場合、23℃では15分以降に凝集体の発生が増えています。
30℃及び42℃では当初から凝集体が発生していて、42℃の場合40分後には、約25000個/mLの凝集体が発生しています。
このような実験をバイオ医薬品の原材料の候補となるタンパク質に対して、様々な条件を設定して繰り返えし実施されます。そして凝集体の生成が無視できるものや無視できる条件(添加剤など)が選択されます。
ここで、粒子径区間を0.2~2μmおよび2~10μmの2つの区間に分けているのは、現時点では、明確な指針ではありませんが、FDAなどの規制当局が推奨している設定に従ったからです。実際、測定対象となる凝集体のサイズと個数が極端に異なるため、1つの区間として個数濃度で評価した場合、大きい方の凝集体の個数はほとんど誤差範囲になってしまいます。しかし、サイズの大きな凝集体の影響は比較的少数であっても無視できません。
qLD法以外にも個数濃度測定のために新しい手法が提案されていますが、現時点では、上記2区間を同時に測定でき、機械的ストレスを与えながら凝集体が生成されるプロセスを観察できることはqLD法の特筆すべき利点と言えます。
|

