分離

アンチセンスなどの核酸医薬は、細胞内外の標的遺伝子と相互作用することで効果を発揮します。 従来の低分子医薬品とは異なり、遺伝子レベルで疾患の原因を標的にすることが可能であり、次世代の医薬品として注目されています。 核酸医薬品は主に化学合成により製造されますが、合成過程では短鎖成分や保護基などの不純物が多数生じるため、目的の核酸を適切に分離・精製する必要があります。
イオン交換クロマトグラフィー(IEX)によるオリゴヌクレオチド分析
本アプリケーションでは、合成目的の配列のオリゴヌクレオチドと鎖長の異なる配列を合成工程由来の不純物と想定し、イオン交換クロマトグラフィーにより分離した例をご紹介します。
装置には、金属イオン由来の吸着現象の抑制と高濃度の酸や塩を含む移動相の使用における耐腐食性を示すUHPLCシステム“Nexera XS inert”を用いました。
-
分析対象のオリゴヌクレオチドの配列を表1に示します。20 merのオリゴヌクレオチドを合成目的の配列とし、表1に示す1~4の3’側が欠損した鎖長の異なる4配列を、伸長不良の不純物として準備しました。いずれも未修飾の一本鎖DNAであり、化学合成品(HPLC精製)を使用しました。これらの計5配列はそれぞれ5 μmol/Lとなるように超純水に溶解し、オリゴヌクレオチド混合試料を調製しました。
- 表1分析対象試料
Sequence (5' ---> 3') Length (mer) 1 TCTTGGTTACATGAAA 16 2 TCTTGGTTACATGAAAT
17 3 TCTTGGTTACATGAAATC 18 4 TCTTGGTTACATGAAATCC 19 5 TCTTGGTTACATGAAATCCC 20
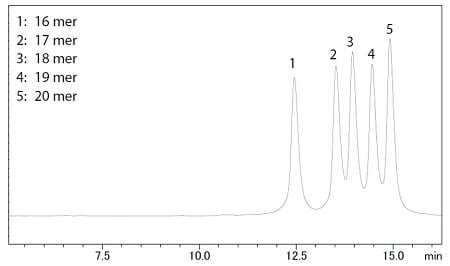
図1 オリゴヌクレオチド混合試料のクロマトグラム
イオン交換クロマトグラフィーではオリゴヌクレオチド中のりん酸基の数、すなわち負電荷の差に基づいて分離されます。そのため、一般的に鎖長の短いものから長いものへと順に溶出します。図1に、5配列のオリゴヌクレオチド混合試料のクロマトグラムを示します。各オリゴヌクレオチドが、塩基単位で鎖長ごとに分離されました。
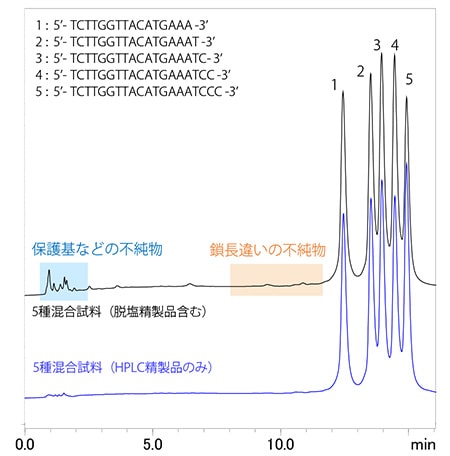
図2 不純物を含むオリゴヌクレオチド混合試料のクロマトグラム
5配列のオリゴヌクレオチドのうち、1配列のみ脱塩精製品、そのほか4種はHPLC精製したものを用いて、各試料5 µmol/Lとなるよう混合し、不純物を含む試料として調製しました。図2に、脱塩精製品を含む混合試料とHPLC精製品のみを含む混合試料ブランクのクロマトグラムを示します。目的のオリゴヌクレオチドが分離できていることに加え、遊離の保護基などの不純物や不完全長のオリゴヌクレオチド鎖などの不純物との分離も確認されました。
オリゴヌクレオチドをイオン交換クロマトグラフィーを用いて分析する場合には、塩基性移動相に塩化ナトリウムなどの塩を添加し、塩濃度を変化させることで分離、溶出させます。塩基性の移動相は、空気中の二酸化炭素を取り込み、pHが変化することが知られています。イオン交換クロマトグラフィーでは、分析種の電荷の違いに基づき分離するため、移動相のpHのわずかな変化が分析結果に大きな影響を与える可能性があります。したがって安定した分析結果を得るためには、移動相のpH変化を抑制することが重要です。本アプリケーションでは移動相pH変化の分析結果への影響について検討した結果についてもご報告します。



