
LC分析の留意点

角田 誠 先生
東京大学大学院 薬学系研究科 (ご所属・役職は2019年7月発行時)
東京大学大学院薬学系研究科博士課程中退。同研究科助手,米国アイオワ州立大学博士研究員。帰国後,東京大学大学院薬学系研究科講師を経て,現在,同研究科准教授。
【専門分野】生体分析化学
【将来の夢】ピラーアレイカラムを多くの研究者に利用してもらうこと,娘とお酒を飲むこと
【趣 味】MLB観戦,スキー,旅行など
■LCは多様な固定相が使用でき,再現性が高いことから,生体分子分析において最も使われている分離分析法である。私は学部生のときに分析の研究室に配属されてから,一貫してLCを用いた研究に従事してきた。
■このLCtalkを読まれている方には,面白くない書き出しであろうか。そう思われた方にも,是非読み進めていただきたい。本稿を通して,LCの近未来をお見せしたい。
■近年,生体試料の分析をクレジットカードほどの大きさのマイクロチップ上で行う「マイクロ化学分析システム」の研究開発が盛んに行われている。試料の前処理部,試薬反応部,分離部,検出部などの機能部位を1枚のチップに集積化することで,生体分子分析の簡便化,迅速化がもたらされると期待されているためである。マイクロ化学分析システムに不可欠な機能部位の一つである分離部についても,私たちを含め多くの研究者が,その分離性能を向上させるための研究に取り組んでいる。
■これまでに,マイクロ化学分析システムにおけるLCを用いた分離部について,4つのアプローチで開発が行われてきた。マイクロチップに作製した中空のマイクロ流路表面を固定相として利用する方法,マイクロ流路内に粒子充塡剤を詰める方法(このカラムは既に市販されている),マイクロ流路内にモノリスカラムを合成する方法,そして最後の一つが,私たちの研究しているピラーアレイカラムである。ピラーアレイカラムが如何に優れた分離媒体であるかについて,私たちの研究成果を含めて以下に述べたい。
■はじめに,ピラーアレイカラム開発の背景に触れる。現在LCにおいて最も汎用されている粒子充塡型カラムには,分離効率に限界があることが理論的に示されていた1)。これは,カラム内部構造(充塡粒子の大きさや充塡状態)の不均一性に由来するものである。このことは一方で,均一な内部構造を有するカラムを作製することができれば,従来のカラムの分離効率を格段に向上させられることを示唆していた。これを実現したのが,ピラーアレイカラムである。ピラーアレイカラムは図1に示すように,数 µm四方の支柱(ピラー)状の構造体がマイクロ流路内に規則的に並んだカラムである。柱の表面を固定相として利用することで,クロマトグラフィーを行う。高度に均一な内部構造の作製は,µmオーダーの構造を設計図通りに作製可能な半導体微細加工技術の利用により実現できる。
■私たちは,フォトリソグラフィーとドライエッチングの手法を用いて,一辺20 mmのシリコン基板上にピラーアレイカラムを作製した(図1)。ピラー構造を有する分離流路と中空の試料注入流路を作製し,この2つの流路が交差する部分を試料注入部として利用した。ピラーは一辺が3 µm の正方形で,ピラー間隔が2 µmとなるように設計した。ピラー表面にoctadecylsilyl基を化学的に結合させることで,逆相分離用の分離媒体として利用した。

図1 ピラーアレイカラム
■ピラーアレイカラムの分離性能を,直線の分離流路を用いて評価した。2種のクマリン色素の分離を蛍光顕微鏡にて検出したところ,注入から数秒で分離される様子が確認された(図2)。これにより,理論的に予想されていたピラーアレイカラムの高い分離効率を,実験的に示すことができた。しかし,小さな基板に作製できる直線流路の長さには限界があり,生体分子の多成分分析は難しい。より高い分離性能を得るためには,曲線流路を伴う長い分離カラムを作製する必要があった。

図2 ピラーアレイカラムを用いた
2種クマリン色素(C525とC545)の分離
■そこで私たちは,内部にピラー構造を有する曲線流路構造の開発を行った2)。単純な曲線構造では,曲線部に起因する拡散がカラムの分離性能を悪化させてしまう。この拡散を抑制するには,図3(A)に示すような内周と外周の距離を等しくした曲線構造が有効であることを見出した。この曲線構造を導入することにより,一辺20 mmのマイクロチップに110 mmの長さのピラーアレイカラムを作製し,蛍光誘導体化7種アミノ酸を100秒以内で分離することができた(図4)。さらに,このピラーアレイカラムを用いて,ヒト血中分岐鎖アミノ酸の定量に成功し,ピラーアレイカラムが生体試料の分析に適用可能であることを世界で初めて示した3)。
■上述の曲線構造は,曲線部の流路幅が狭いために流路抵抗が大きく,高流速での高速分離が困難であった。そこで新たに,図3(B)に示すような低拡散かつ低流路抵抗の曲線構造を開発した4)。曲線部のピラー密度を調整し,曲線部内外における移動相の速度分布を制御したことで,流路幅を一定にしたまま拡散を抑えることに成功した。この曲線構造をピラーアレイカラムに導入することで,高流速での分離が可能となり,蛍光誘導体化6種アミノ酸を24秒以内で分離できるようになった。
■この他にもさらに,オンチップミキサーを利用した迅速グラジエント溶離システムの開発5),親水性相互作用クロマトグラフィーモードのためのピラーアレイカラムの開発6)などを行い,ピラーアレイカラムの生体分子分析への応用可能性を広げる研究を続けている。具体的には,文献を参照されたい。
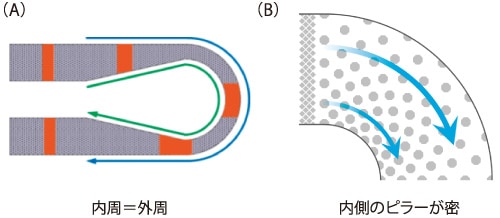
図3 開発した曲線構造
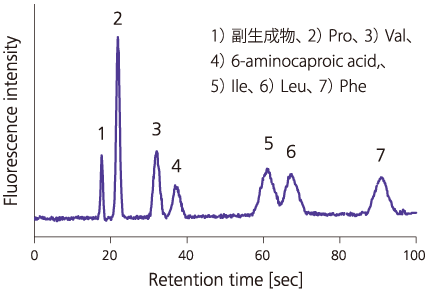
図4 ピラーアレイカラムを用いた蛍光誘導体化アミノ酸の分離
■また私たちは,ピラーアレイカラムを用いた分離部だけでなく,試料の前処理部や試薬反応部の開発も行っている。様々な要素技術を開発し,1枚のマイクロチップ上に集積化していくことで,生体分子分析の工程すべてを可能にするマイクロ化学分析システムの構築を目指している。近い将来,皆さんにこの優れたカラムを利用していただくことを夢みている。大学の一研究室で出来ることは限られており,その実現のためには,カラムやチップのみならず,周辺機器等の開発も不可欠である。島津製作所をはじめとした産業界のご協力やご支援をお願いするとともに,私たちも引き続き夢に向かって研究に邁進していきたい。
参考文献