2.気泡発生のメカニズム
さて,それでは気泡発生のメカニズムについて確認してみることにしましょう。気泡が発生する,ということは,溶液に対する空気の溶解量が飽和溶解量(飽和溶解度)を超える,ということです。飽和溶解量は,溶液を放置した時に空気の出入りが起こり(平衡),最終的に溶解している量だと考えて下さい。しかし,この量は溶液の種類,気体の種類,また温度・圧力によって異なります。
従って科学的には,「25℃の水に接する酸素の分圧が0.2気圧のとき水1mLに対する酸素の飽和溶解量は,25℃1気圧換算で0.006mLである」などと表現します。
飽和溶解量以上に溶解している場合を過飽和といい,振動やかくはんによって容易に気泡が発生します。一方,飽和溶解量以下の溶液に対しては,気体が溶け込みやすいわけですが,その速度はあまり速くありません。
* 1気圧(1atm) = 1.033 kgf/cm2= 1.013×105Pa
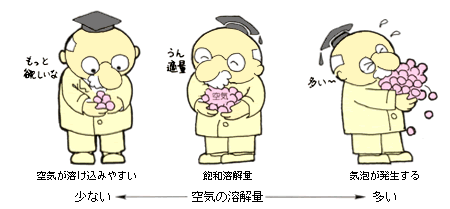
図2 飽和溶解量のイメージ
2-1)液温上昇
倉庫で冷えていた溶媒を,暖かい室内で用いる場合など,温度が上がると一般に気体の飽和溶解量が減少するため,過剰に溶解している気体が気泡となって出てくることになります。 コーラを温めて開封した方が,炭酸ガス(CO2)が勢いよく発生するのはこの原理です
図3中に,水に対するO2,N2の飽和溶解量曲線がありますが,気体の分圧が1気圧の場合で示されています 実際の空気は,O2=20%,N2=78%ですから,接液する気体が空気の場合,O2,N2の溶解量は,それぞれ約0.2,0.8を乗じたものになります。
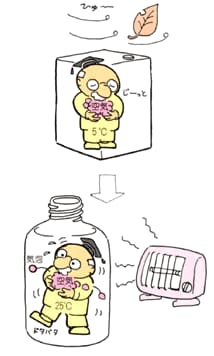
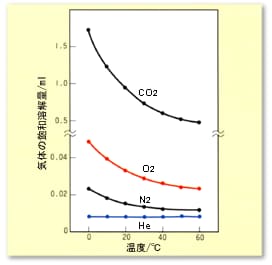
図3 水1mLに対するCO2,O2,N2,He溶解量への温度影響(気体分圧1atm)
一般に気体は,圧力(分圧)が高いほど液体への溶解量が多くなります(図4)。 逆に言えば,圧力の高い状態で飽和溶解していた気体は,圧力が下がると気泡になって出てくることになります。

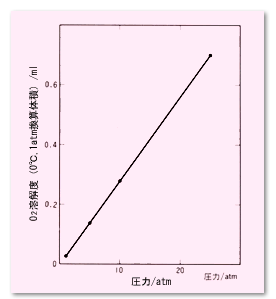
図4 水1mLに対するO2の溶解度への圧力(分圧)の影響(25℃)
2-3)異なる溶媒の混合
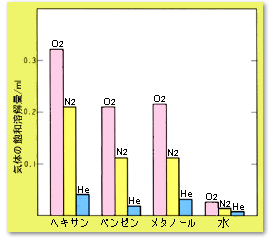
気体の飽和溶解量は,液体の種類によって異なります。 概して,極性の低い気体は,極性の低い溶媒に溶けやすくなります。 図5では,ベンゼンとメタノールへの体積当りの気体の溶解量がほぼ同じことを示していますが,これを溶媒のモル数当りの溶解量,つまりモル分率で計算すると,溶媒の極性が低いほど溶解度が高いことが鮮明になります。
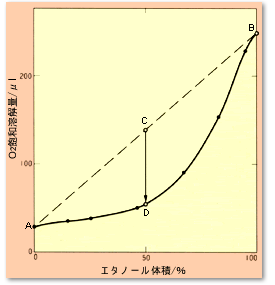
それでは,異なる溶媒を混合すると飽和溶解量はどうなるのでしょうか?答えは,単独溶媒の溶解量の和に比べて小さくなる,というのが一般的です。 図6に,水-エタノール混合溶液へのO2溶解量(分圧1気圧)を示しました。 A点は水100%への溶解量,B点はエタノール100%への溶解量です。 水とエタノールを同量混合した時には,C点に相当するO2が溶液に存在するわけですが,この溶液の飽和溶解量はD点しかないため,C→D相当のO2が気泡として発生することになります。 同じようなことが,水-メタノール,水-アセトニトリルへの空気の飽和溶解量にもみられます。
* 1気圧(1atm) = 1.013×105Pa
 |
||
|
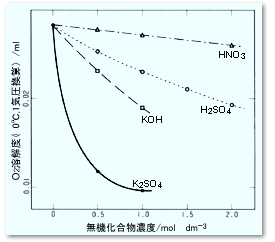
また,混ぜる溶媒が水同士であっても気泡発生が生じる場合があります。 というのは,一般に塩濃度が上がると空気の飽和溶解量が下がるが,その関係は直線的ではなく図7のように下に凸の曲線を示す場合があるからです。
 |
||
|
 |
||
|
| <参考文献> | S.R.Bakalyar,M.P.T Bradley and R.Honganen,J.Chromatogr., 158,277-293(1978) |
| 化学便覧 基礎編II 8.7溶解度,日本化学会編 丸善株式会社(1984) |


