KBr錠剤法
フーリエ変換赤外分光光度計(FTIR)には各種測定手法がありますが,それらのうち広く用いられている測定手法に臭化カリウム(KBr)錠剤法があります。このKBr錠剤法は最も基本的な測定手法で様々な試料,分析目的に用いることができますが,いくつかの特長、注意すべき点があります。今回KBr錠剤法について試料の作製方法,実際の測定例をまじえ解説いたします。
1. 錠剤法
測定試料に光を照射し試料を通過した光を検出する透過測定にはいくつかの種類があります。例えば液体試料を透過法で測定するための手法として液膜法があります。KBr錠剤法は主に固体試料を測定するための測定手法です。錠剤法はハロゲン化アルカリが可塑性を持ち、圧力を受けると赤外領域で透明な板になるという性質を利用していま す。錠剤用に用いられるハロゲン化アルカリとしては臭化カリウム(KBr)が最も一般的で,塩化カリウム(KCl)やヨウ化セシウム(CsI)が用いられることもあります。
第十五改正日本薬局方において錠剤法は,
「固体試料1~2mgをめのう製乳鉢で粉末とし,これに赤外吸収スペクトル用臭化カリウム又は塩化カリウムを0.10~ -.20gを加え,湿気を吸わないように注意し,速やかによくすり混ぜた後, 錠剤成型器に入れて加圧製錠する.」
と記述されています。
錠剤を作成する際には測定試料に対して臭化カリウムをおよそ100倍程度加えることが必要とされています。
2.臭化カリウムなどの取り扱い
錠剤作成に使用する臭化カリウムなどは潮解性があり大気中の水分を吸収します。水には中赤外領域に吸収があるためKBr錠剤法で使用する臭化カリウムは,デシケータなどで保存し水分を吸わないようにすることが重要です。
保存の際には粉末状の臭化カリウムより図1のような結晶状の臭化カリウムの方が優れています。これは結晶状の臭化カリウムは粉末のものより重量に対する表面積が小さく,重量あたりの吸湿量が少ないためです。

3. KBr錠剤の形成
錠剤の成型は以下の手順で行います。
(注意)器具類(めのう製乳鉢,錠剤枠)はアルコールで洗浄,乾燥した上で使用してください。
- 測定試料をめのう製乳鉢で粉砕します。
- KBrを用意し,めのう製乳鉢で粉砕します。大気中の水分をKBrが吸収するのでなるべく手早く行います。
- 図2に示すようにKBr100mgに対して試料を0.5~1mg加え,試料とKBrがよく混ざるようめのう製乳鉢ですり混ぜます。KBrの粉砕同様手早く行います。
(φ4mmのKBr錠剤を数個作成できる量です。錠剤のサイズに応じて調整してください。) - 錠剤を作製します。
- 別途バックグラウンド測定用にKBrのみで作製した錠剤を用意します。KBrのみの錠剤を用いてバックグラウンド測定を行うことで錠剤による赤外光の散乱損失とKBrに吸着した水分による影響を補正することができます。

4. KBr錠剤の試料濃度
KBr錠剤の試料濃度はスペクトルの一番大きなピーク強度が透過率で10%程度(吸光度で1Abs程度)になるようにすると良いとされています。図3に最大ピーク強度が透過率で約10%になるように調製した乳糖のKBr錠剤の赤外スペクトルを示します。
最大ピーク強度が小さい場は,ピークと比較してノイズがより大きく見えます。
それに対して濃度が高くなると図4のように最大ピーク強度が0%に近づいて吸収ピークが飽和していきます。吸収ピークが飽和すると正確なスペクトルが得られませんので注意が必要です。
試料濃度は吸光度を参考にして調整すると簡単です。ランバート-ベアーの法則に従い吸光度は試料濃度に比例するためです。最大ピーク吸光度が0.5だった場合には、試料濃度を2倍にする良いでしょう。
5. 水分の影響
同じようにKBr錠剤を作製しても室内環境の変化によって錠剤中の水分量が変わる場合もあります。このような吸湿したKBr錠剤では赤外スペクトル上に水の吸収が見られたり,KBr錠剤のくもりによる散乱でベースラインが変動したりするようになります。
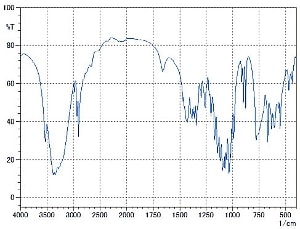
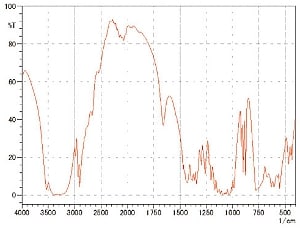
図5にカフェインのKBr錠剤で,水分の少ない錠剤と水分を多く含む錠剤の測定結果を示します。水分を含む試料はくもりによりベースラインが変動し,さらに水の吸収が確認できます。
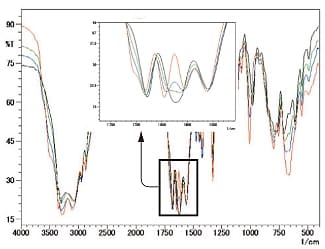
また水分の影響でスペクトル形状の変化が見られることもあります。図6にL-アルギニンをKBr錠剤法で測定した結果を示します。赤線が錠剤作製直後,青線,緑線,黒線がそれぞれ1,3,10分間ドライヤーで乾燥させた後のスペクトルです。
挿入図は1400~1800cm-1の拡大図です。3500cm-1付近のO-H基による吸収の減少と併せて,1500~1750cm-1付近のピーク本数が4本から3本に変化していくことが分かります。このように試料によっては含まれる水分がスペクトル形状に影響を及ぼすことがあります。
6. 塩酸塩の測定
塩酸塩を臭化カリウム(KBr)錠剤法で測定した場合には塩素イオンと臭素イオンの間でイオン交換反応が起こり,本来得られるはずの赤外スペクトルとは異なるスペクトルになることがあります。
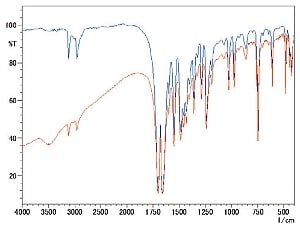
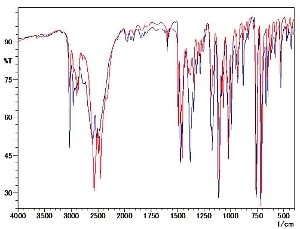
ジフェンヒドラミン塩酸塩(塩酸ジフェンヒドラミン)をKBr錠剤法及びKCl錠剤法で測定した結果を図7に示します。
明らかに3000cm-1付近のスペクトル形状が異なっていることが分かります。また低波数領域においても様々な場所に違いが見られます。KBr錠剤法ではイオン交換によって赤外スペクトルが変化したと思われます。
このようなイオン交換の起こる試料においては臭化カリウム(KBr)の代わりに塩化カリウム(KCl)錠剤法を使用することで目的とする赤外スペクトルが得られます。
詳しくは「KBr錠剤法の注意点」をご参照ください。)
7. まとめ
KBr錠剤法は固体の赤外吸収を測定する基本的な方法として知られております。しかしながらKBrは潮解性があり水分の影響を受けやすく,また塩酸塩を測定する際にはイオン交換反応などがあり注意しなければなりません。これらの点に留意していただければさまざまな試料を測定することができる測定法です。


