N2キャリアを用いた、非水溶試料による医薬品残留溶媒の分析(第十七改正日本薬局方第二追補、USP467)
医薬品残留溶媒の試験法は、第十七改正日本薬局方やUSP(米国薬局方)General Chapters<467> Residual Solvents に規定されており、主にヘッドスペースGC 法が用いられます。医薬品中の残留溶媒はヒトの健康に及ぼし得るリスクに基づいてクラス1 からクラス3 に分類され厳密に管理されており、高感度な分析が求められています。分析の際に一般的に使用されるキャリアガスはHe ですが、昨今He の枯渇が問題となっているため、N2 などの代替キャリアガスを用いた分析が求められています。第十七改正日本薬局方第二追補に準拠し、キャリアガスにN2 を用いた、クラス1・クラス2 の非水溶性試料の分析結果を紹介します。
分析条件
ガスクロマトグラフNexis™ GC-2030 と島津ヘッドスペースガスサンプラHS-20 を接続し、第十七改正日本薬局方第二追補に準拠し、記載されたクラス1 およびクラス2 の標準溶液を調製し、カラムの種類、カラム温度、スプリット比の異なる操作法A および操作法B で測定しました。非水溶性試料測定におけるGC およびHS-20 分析条件を表1 に示します。
表 1 水溶性試料 分析条件
GC 分析条件(操作法A・操作法B)
| Model | Nexis GC-2030 |
| Detector | 水素炎イオン化検出器 FID-2030 |
| Column |
A) SH-Rxi™-624 Sil MS (0.53 mm I.D.×30 m,
d.f.= 3 μm B) SH-Stabiliwax (0.32 mm I.D.×30 m,
d.f.= 0.25 μm) |
| Column temperature | A) 40 ℃ (20 min) ‒ 10℃/min ‒ 240℃ (20 min) Total 60 min B) 50 ℃ (20 min) ‒ 6 ℃/min ‒ 165 ℃ (20 min) Total 59.17 min |
| Injection Mode | A) Split 1:5 B) Split 1:10 |
| Carrier Gas Controller | 線速度 (N2) |
| Linear Velocity | 35 cm/sec |
| Detector Temperature | 250 ℃ |
| FID H2 Flow Rate | 32 mL/min |
| FID Make up Flow Rate | 24 mL/min (N2) |
| FID Air Flow Rate | 200 mL/min |
| Injection Volume | 1 mL |
HS-20 分析条件(操作法A・操作法B 共通)
| Oven Temperature | 80 ℃ |
| Sample Line Temperature | 90 ℃ |
| Transfer Line Temperature | 105 ℃ |
| Vial Stirring | Off |
| Vial Volume | 20 mL |
| Vial Heat-retention Time | 45 min |
| Vial Pressurization Time | 1 min |
| Vial Pressure | 68.9 kPa |
| Loading Time | 0.5 min |
| Needle Flush Time | 5 min |
クラス1 標準溶液分析(非水溶性試料)
図1 に操作法A の分析結果を、図2 に操作法B の分析結果を示しました。またそれぞれのピークにおけるSN 比および再現性結果を表2 および表3 に示します。操作法A では「1,1,1-トリクロロエタンのピークのSN 比は5 以上、個々のピーク面積の相対標準偏差が15%以下」と良好であり、操作法B では「ベンゼンのピークのSN 比は5以上、個々のピーク面積の相対標準偏差が15%以下」と良好な結果が得られました。
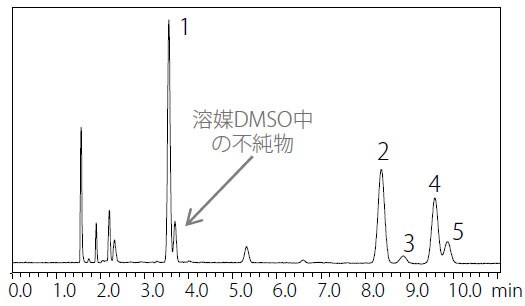
図 1 操作法A によるクラス1 標準溶液クロマトグラム(非水溶性試料)
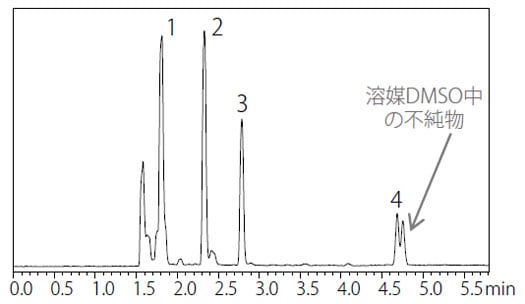
図 2 操作法B によるクラス1 標準溶液クロマトグラム(非水溶性試料)
表 2 クラス1標準溶液SN 比および再現性 操作法A
| ピークNo. | 化合物 | SN 比*1 | 相対標準偏差% (n=6)*1 |
| 1 | 1,1-Dichloroethane | 325 | 2.95 |
| 2 | 1,1,1-Trichloroethane | 140 | 3.08 |
| 3 | Carbon tetrachloride | 12 | 2.83 |
| 4 | Benzene | 140 | 2.72 |
| 5 | 1,2-Dichloroethane | 46 | 1.67 |
表 3 クラス1標準溶液SN 比および再現性 操作法B
| ピークNo. | 化合物 | SN 比*1 | 相対標準偏差% (n=6)*1 |
| 1 | 1,1-Dichloroethane | 290 | 2.15 |
| 2 | 1,1,1-Trichloroethane | 383 | 3.44 |
| +Carbon tetrachloride | |||
| 4 | Benzene | 188 | 3.79 |
| 5 | 1,2-Dichloroethane | 94 | 1.46 |
表2 および表3 において、規定項目については赤字で記しました。
*1 SN 比および相対標準偏差は参考値であり、保証値ではありません。
クラス2 標準溶液分析(非水溶性試料)
図3 に操作法A の分析結果を、図4 に操作法B の分析結果を示しました。(クラス2A:黒、クラス2B:ピンク、MiBK:青)システム適合性について、操作法A では「アセトニトリルとジクロロメタンのピークの分離度は1.0 以上」であり、操作法B では「アセトニトリルとcis-1,2-ジクロロエテンのピークの分離度は1.0 以上」であり、良好な結果が得られました。 * 図中に記す分離度は参考値であり、保証値ではありません。
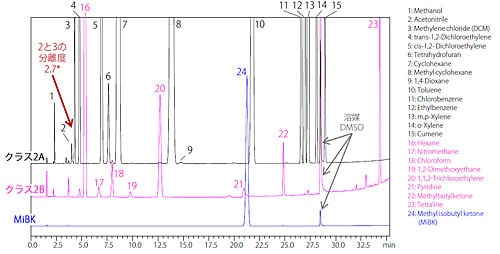
図 3 操作法A によるクラス2 標準溶液クロマトグラム(非水溶性試料)
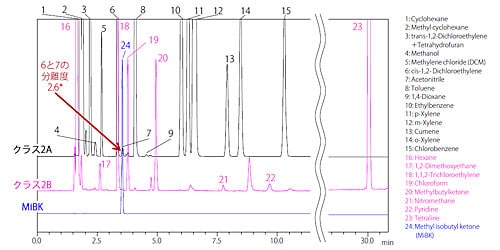
図 4 操作法B によるクラス2 標準溶液クロマトグラム(非水溶性試料)
ヘッドスペースGC 法を用いた非水溶性試料による医薬品残留溶媒分析において、キャリアガスにN2 を用いた場合でも、He キャリアガスと同等の良好な分析結果が得られました。
関連するアプリケーション

医薬品中残留溶媒分析システム
- 医薬品中残留溶媒の分析は,最終製剤,原薬,医薬品添加物などの検体を適当な溶媒に溶解させ,バイアル中に封入し一定時間加熱し,バイアル中の気相部分の揮発成分を分析するヘッドスペース法が主流となっています。
- 医薬品中残留溶媒の分析では,スプリット比の設定が容易であり検出器ガスを含めたフルデジタルを流量制御を行うことのできるキャピラリガスクロマトグラフNexis GC-2030と高い再現性と低いキャリーオーバーによって,いつでも正確な定量ができるヘッドスペースサンプラHS-20の組合せが最適です。
- FIDは,世界最高感度1.5 pgC/secであり,微量溶媒の検出を逃しません。また,ワークステーションLabSolutions(GC)と組み合わせてご使用いただくことにより,ヘッドスペースの分析条件も同一メソッドとして管理,保存が可能です。


