
CELL PICKER™

INDUSTRY
ライフサイエンス
キーワード
紹介する製品・サービス
CELL PICKER™
飯森先生は,臨床ですでに使用されている作用機序が明らかとなっていない抗がん剤をより詳しく解析し,制がん効果をより詳細に「知る」ことで,さらなる制がん効果を得ることを目的とした「育薬」というアプローチで研究を進めておられます。「育薬研究」を外科学の教室や製薬会社との共同研究で進めるなかで,CELL PICKERを知ったきっかけやご活用方法を伺いました。

飯森 真人 先生
薬学研究院 抗がん剤育薬共同研究部門
*お客様のご所属・役職は掲載当時のものです。
九州大学
URL
https://kyushu-u.pure.elsevier.com/ja/persons/makoto-iimori
先生のご研究の内容についてご紹介ください。

飯森先生とCELL PICKER
抗がん剤がなぜ効果を得ているのか,あるいはどのようなメカニズムで耐性化に繋がるのかについて研究を進めています。抗がん剤補助化学療法のさらなる治療成績向上につながるような基礎研究を行っています。一例として,すでに大腸がん・胃がんで使用されている抗がん剤ロンサーフ(FTD-TPI)に関する育薬研究を行っています(下図)。発売当初はFTDが細胞周期のDNA複製期において染色体のDNAに取り込まれることが抗腫瘍効果に必要であることは分かっていましたが,その作用機序は十分に理解されていませんでした。そこで,私たちはFTDによって誘導される細胞応答を観察することで,FTDがDNAに取り込まれる際にDNA複製を非効率化させDNA複製ストレスをあたえることを明らかにしました。さらに,DNA複製ストレスがp53-p21を活性化させ分裂期のスキップとその後の細胞老化様細胞停止を誘導することを見出しました。またゲノム編集によるp53ノックアウト細胞やミスセンス変異ノックイン細胞ではDNA複製ストレス後に分裂期に移行し,大規模な染色体分配異常とその後の細胞死を誘導することが観察されました。また,thymidine kinase 1(TK1)の発現レベルがFTD耐性化に寄与することを明らかにし,がん組織におけるFTDの可視化法なども開発することにより,臨床応用を視野に入れたアプローチも行っています。
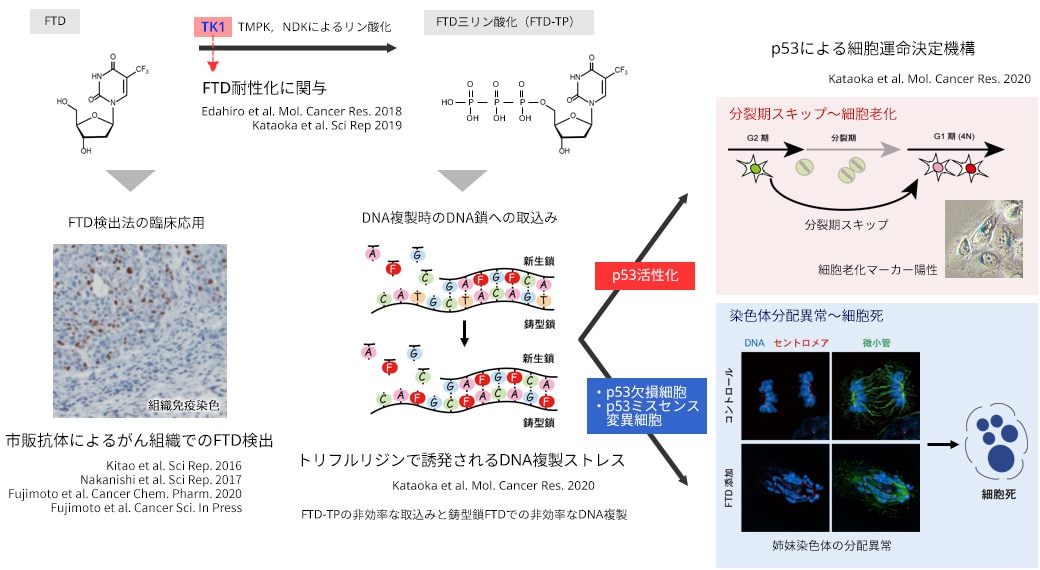
トリフルリジン・チピラシル塩酸塩FTD/TPIの作用機序を知る「育薬」
CELL PICKERを知ったきっかけを教えてください。

北尾研究室の実験室
ゲノム編集技術がCRISPR/Cas9システムの登場により一般化したこともあり,私たちの研究室においてもノックアウトあるいはノックイン細胞株樹立の機会がますます増えていました。さらに,細胞株樹立の際に必要となるコロニーの単離が実験の初心者にとって技術的・時間的に律速になっていました。また経験が豊富な人でも,コロニーの単離作業は時間的な負担となっていました。
そのような背景において,学会の展示会で訪れた島津製作所ブースでCELL PICKERを知り,さらに実機を拝見させていただく機会を得られ,興味を持ちました。
お問い合わせいただいた当時のCELL PICKERへの期待感はどのようなものがありましたか?
これまでに興味のある遺伝子の安定発現細胞株や遺伝子ノックイン・ノックアウト細胞株を樹立する際には,クローニングリング法や限界希釈法によるコロニー単離を行っていました。クローニングリング法の操作は,ある程度の技術的な習熟度を要します。また単離するコロニーを囲む様にリングを配置させるためコロニー形成密度に細心の注意を払う必要がありました。コロニー形成密度は,細胞株の種類やプラスミドの細胞への導入効率に依存するため,あらかじめ複数条件の希釈率で遺伝子導入後の細胞を播種しており多くのディッシュを必要としました。しかし,CELL PICKERではコロニーを直接単離できるとのことで,コロニー密度をあまり気にする必要が無いのではと考えました。限界希釈法はさらに時間と労力を要するためコロニー単離作業の時間的な律速を感じていました。
デモンストレーションで実際にディッシュ上の細胞コロニーの単離を行いましたが、その際どのようなご感想をお持ちになりましたか。また導入の決め手になった点を教えてください。

細胞コロニー単離操作の様子
まず,サイズがコンパクトで,クリーンベンチ内での操作がしやすいと感じました。またピッキング時の動きもスムーズで,時間的なストレスも感じることはありませんでした。さらに,タブレット端末でディッシュ上の細胞の画像を見ながら操作するため,作業者自身が顕微鏡を覗く必要が無く,クリーンベンチの開口が最低限で済むため無菌操作の観点からも有用であると感じました。
導入の決め手は,デモンストレーションで操作を行ったラボメンバーの細胞コロニー単離スキルに個人差があった(日常的にクローニングリングを使った単離をしている人から,クローニング操作自体を見たことの無い人まで)にも関わらず,全員が特段の説明も無しにコロニー単離ができてしまった事実です。これは,熟練者はもちろん,研究室に配属された学生でもすぐに操作ができるということになります。細胞のクローニングはコロニー形成をさせるために1-2週間程度の時間がかかるため,研究の時間と費用を無駄にしないためにも迅速・簡便かつ確実なコロニー単離技術は重要であると考えています。
導入後は、どのようなシーンや目的でご使用いただいていますか。工夫されている点などもあれば教えてください。
ゲノム編集技術であるCRISPR/Cas9システムを用いたノックアウトあるいはノックイン細胞株を樹立するために日常的に使用しています。これまでに,遺伝子ノックアウト,点突然変異のノックイン,GFPなどの蛍光タンパク質やタグ配列のノックインなどを経験しています。最近は国立遺伝学研究所の鐘巻将人先生のグループが開発されましたオーキシンデグロン法による時期特異的なタンパク質分解法を私たちの研究室でも重宝しており,その際にもCRISPR/Cas9システムで興味のある遺伝子にmAIDタグを付加するためにノックインをしています。
また,興味のある遺伝子の安定発現株の取得もこれまではランダムにゲノムに組み込んでいましたが,最近はCRISPR/Cas9システムによりセーフハーバー座位であるAAVS1を切断してそこに遺伝子発現プラスミドを組み込むようにしています。以上のような操作で目的の遺伝型の細胞を取得した後に,Cre RecombinaseによりloxP配列にはさまれた薬剤耐性カセットを除去し,さらに必要なレポーター遺伝子を組み込むといった流れで,目的の実験に必要な細胞株を樹立しています。この各ステップで細胞コロニー単離が必要となるため,細胞を樹立している間は常にCELL PICKERが必要になります。(右図)
工夫している点は,ピックアップしたコロニーを細胞解離溶液にいったん入れるようにしています。その際に使用する溶液は,トリプシン溶液ではなくTrypLE試薬(Thermo社)を採用しています。TrypLE試薬を使用すると,48コロニーをピックアップしている最中に細胞が細胞解離溶液に浸り続けていても,その後の良好な細胞接着性が確認できています。
興味のある遺伝子末端にタグ(GFP, FLAGなど)を融合させるノックイン細胞を作製する流れ

さらなる期待はありますか?

北尾先生(左から3人目)と飯森先生(左から2人目)とラボメンバーの皆さん
現状はチップ装着と播種時の96ウェルディッシュの位置決めを手動で行っていますが,自動化装置を現在開発しておられると伺っておりますので,そこは非常に期待しております。またピッキングに関しては,細胞の種類によってピッキングの具合が異なることが分かりました。例えば,ピッキングによってコロニーの一部が削れる細胞もあれば,コロニー形成時の細胞間接着が強いためにコロニー全体が一枚のシート状になって剥がれる細胞もあります。ピッキング動作のバリエーションが増えると,これらの違いに対応できてピッキングの効率がさらに向上させられるのではないかと思います。
本文中でご紹介しているCELL PICKERは、医薬品医療機器法に基づく医療機器として承認・認証等を受けておりません。
治療診断目的およびその手続き上での使用はできません。