核酸の熱安定性解析(Tm解析)
PCR,DNAマイクロアレイなど,核酸のハイブリダイゼーション(Hybridization)に基づく手法はライフサイエンス研究に不可欠になっています。また,核酸医薬品,siRNA(small interference RNA)をはじめとする機能性核酸が注目を集めています。これらの研究開発、応用に必須となった核酸の熱安定性解析(Tm解析)について概説します。
1. 核酸の熱的挙動
DNAは通常,二重鎖らせん構造をとっています。二重鎖ではセンス鎖,アンチセンス鎖の相補的塩基[G(グアニン)とC(シトシン)およびA(アデニン)とT(チミン)]が対をなし,相補的塩基対の間には水素結合が形成されています。温度を上昇させると、水素結合が切断され,二重鎖は解離し,一本鎖の構造をとります。この現象を核酸の融解(Melting)と呼びます。
核酸は260nm付近に紫外吸収ピークを持ち,融解の際に260nmにおける吸光度は増加します。温度上昇と吸光度の連動測定により得られたデータ曲線を紫外吸収-融解曲線と言います。融解曲線は紫外吸収測定以外にも、円偏光二色性測定、熱測定などにより得られます。融解温度( Tm, Melting Temperature)では,二重鎖と一本鎖の占める割合が等しくなります。Tmは核酸の熱安定性を表す指標となり,塩基配列,塩基数,核酸濃度,溶媒条件(塩組成,有機溶媒組成, pH),ミスマッチ(非相補的塩基対),核酸アナログ(人工核酸) の構造などの条件に依存します。
融解とは逆に,一本鎖の状態にある核酸の温度を下げると, 相補的塩基対の間に水素結合が形成され,二重鎖の構造を とります。この現象をハイブリダイゼーションと呼びます。核 酸のハイブリダイゼーションはPCR,DNAマイクロアレイ,サザンハイブリダイゼーション,ノーザーンハイブリダイゼーション,in situハイブリダイゼーションなどに利用されています。siRNA,アンチセンス核酸,アンチジーン核酸,リボザイムなどの機能を有する核酸(機能性核酸)が創薬研究,医薬品,診断などに応用されています。核酸の熱安定性は核酸の構造,ハイブリダイゼーション,機能を支配する重要な因子であり,これらの分野で核酸の熱安定性解析(Tm解析)は必須となっています。
2. 可視光透過率,可視光反射率
以下,核酸の熱安定性解析(Tm解析)について簡単に説明します。2つの異なる一本鎖(A1,A2)と二重鎖(A1A2)の間に二状態的な平衡関係が成立し,A1,A2の濃度が等しいと仮定します。
二重鎖のモル分率をα,核酸総濃度をCtとすると,系に対する平衡定数Kは以下のように表せます。
観測される260nmにおける吸光度(Aobs)は以下になります。
εds,εss,Lはそれぞれ二重鎖のモル分子吸光係数,一本鎖のモル分子吸光係数,光路長です。
実際の測定で得られる融解曲線では図1のようにεds,εssが温度依存性を持ち,大きな吸光度変化が起こる領域(遷移領域)より低温側の前遷移領域と高温側の後遷移領域の吸光度が直線的に変化するため,εds,εssを以下のように表します。Tは温度です。
融解曲線からTm(融解温度)を求める場合は,α=1/2のときに温度がTmとなることを利用します。図1のように前遷移領域と後遷移領域に対してベースラインを定めます。次に,2つのベースラインの中線を引き,この中線と融解曲線が交差する温度(Tm)を求めます。
二重鎖形成のGibbsの自由エネルギー変化,エンタルピー変化,エントロピー変化をΔG,ΔH,ΔSとし,モル比熱の変化(ΔCp)をゼロと仮定すると,下式が得られます。Rは気体定数です。
(2)式を(6)式へ代入し,温度がTmのときはα=1/2により下式が得られます。
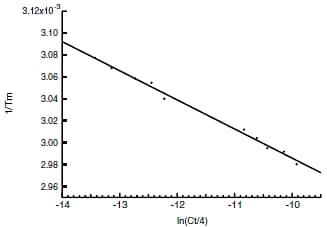
上式より種々の濃度(Ct)のサンプルを用意し,それぞれのTmを求め,ln(Ct/4)に対して1/Tmをプロットし,得られた直線の傾き,y切片からΔH,ΔSが求まります。
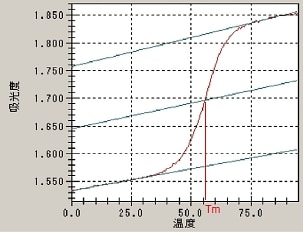
図1. 融解曲線の例,Tmの決定方法
3. 紫外可視分光光度計を用いたTm解析例
弊社では核酸の熱安定性解析を実現するために,Tm解析システムをダブルビーム型紫外可視分光光度計( UV-1800/UV-2450/UV-2550等)のオプションとして販売しています。Tm解析システム(TMSPC-8)は電子冷熱式8連セルホルダー,温度コントローラー,Tm解析ソフトウェア,専用8連セル(光路長10mm,1mm)などから構成されます。8連セルの採用により,同時に最大8サンプルの熱融解測定が可能になります。
Tm解析システムによるTm測定データと熱安定性解析の例を以下に示します。
GCGAAAAGCG / CGCTTTTCGCをサンプルとして,濃度が異なる10サンプルのデータを取得しました。濃度は表1に記載しています。サンプルの吸光度に応じて,光路長 10mmまたは1mmのセルを用いました。得られたデータを図2,図3に示します。測定条件を以下に示します。
測定条件
| Buffer | : 150mM Sodium Phosphate, 1M NaCl, 0.5mM EDTA, pH7.0 |
| Wavelength | : 260nm, 320nm |
| Temperature Range | : 0 to 95℃ |
| Ramp Rate | : 1℃/min |
| Sampling Interbal | : 0.5℃ |
| Waiting Time | : 30sec |
| After Annealing | : 95℃, 2min |
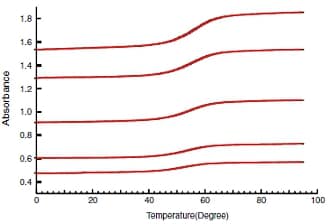
図2. 光路長10mmでの測定結果
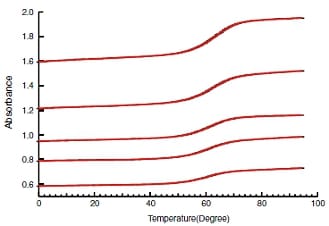
図3. 光路長1mmでの測定結果
| Ct(μm) | Tm(℃) | lnCt/ 4 | 1 / Tm (K-1) |
| 196.4 | 62.4 | -9.9217 | 0.002980 |
| 157.1 | 61.1 | -10.1448 | 0.002992 |
| 117.8 | 60.8 | -10.4325 | 0.002995 |
| 98.2 | 59.7 | -10.6148 | 0.003004 |
| 78.6 | 58.9 | -10.8379 | 0.003012 |
| 19.6 | 55.6 | -12.2242 | 0.003042 |
| 15.7 | 54.2 | -12.4474 | 0.003055 |
| 11.8 | 53.8 | -12.7351 | 0.003058 |
| 7.9 | 52.8 | -13.1405 | 0.003068 |
| 5.9 | 51.8 | -13.4282 | 0.003077 |
Tm解析ソフトウェアで各濃度のTmを決定し,1 / Tm ,ln(Ct/4)を計算しました。表1のデータをプロットし,図4の直線を得ました。この直線の傾き,y切片により,ΔH,ΔSとしてそれぞれ-74.6kcal/molならびに-202.9cal/(molK)を得ました。
ΔH,ΔSを求める方法としては上記のプロット以外に,融解曲線の非線形フィッテングを実施する方法もあります。