
お客様のご意見・ご要望のご紹介

野村 淳子 先生
東京科学大学 社会連携・DE&I本部 DE&I部門 (ご所属・役職は2025年4月発行時)
シンクロトロン光源や液体ヘリウムで冷却した特殊な検知器などを用いず、市販されているFT-IRにより、固体酸化物を測定対象として、遠赤外領域(< 400 cm-1)のスペクトルを得ることに成功した。具体的には、カチオン交換型ゼオライトの[アルカリ金属]―[格子酸素]の振動観測に加えて、分子性カチオン(アンモニウムやピリジニウムカチオン)の吸着・脱離挙動もin-situ測定によって確認した。本稿では、得られた結果を紹介し、さらにそれら知見により推測された「ゼオライトの固体酸触媒としての特異性」について議論する。
通常のFT-IRで観測されているのは中赤外領域(波数範囲4600‒400 cm-1)で、それより高波数側を近赤外領域(20000‒4600 cm-1)、低波数側を遠赤外領域(400‒50 cm-1)という。中赤外領域では分子の基準振動による吸収が見られるため、様々な研究分野で広く用いられており、近赤外領域では倍音や結合音が観測され、食品・農業など多様な分野での成分分析や品質管理のツールとしての役割を果たしている。一方で、遠赤外領域では非常に弱い「相互作用」のエネルギーに相当する吸収を観測することができる。例えば、固体表面に分子が吸着した際には、その分子が気相にいた際に持っていた並進運動と回転運動の自由度が失われ、代わって図1 に示したような吸着に由来する3つの振動が現れる[1, 2]。この「吸着」という弱い相互作用に起因する振動エネルギーの吸収が、遠赤外領域に現れる。したがって、固体触媒の活性点と吸着分子の相互作用の強さを調べる方法としては、従来行われているプローブ分子の内部振動(図1では吸着したCOのCO伸縮振動)を観測するよりも直接的で、理想的である。しかしこの手法は様々な理由から、ほとんど利用されてこなかった(後述)。
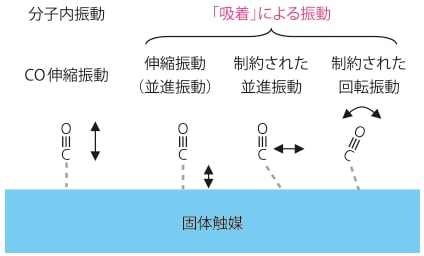
図1 吸着したCOの振動モード
ゼオライトはシリカ(SiO2)を主成分とした結晶性多孔質材料で、シリコン(Si)の一部がアルミニウム(Al)に同型置換したアルミノシリケートは代表的な固体酸触媒として知られ、H-ZSM-5 に代表されるように、主に石油化学産業で実用触媒として用いられている。酸触媒活性種は、AlとSiに橋かけ結合した酸素(O)の上に存在するプロトンで、室温付近では酸性水酸基(酸性OH基)として赤外(IR)分光法で明瞭に観測することができる(図2)。固体触媒の研究ではIR 法を用いてこれまで、酸性OH基と吸着分子の相互作用や[3-5]、酸性OH基から吸着分子にプロトンが取り込まれる反応の詳細な観測[6, 7]、および触媒反応全体の機構に関して様々な知見が得られてきた[8-10]。それら一連の研究の中で著者らは、酸触媒反応においてゼオライトが他の金属酸化物と一線を画す理由に注視し、高温でのプロトンホッピング[11]や、Alに結合した酸性OH基を形成しない格子酸素の塩基性を検討した結果[12]、ゼオライトではその細孔構造に由来した「電荷の非局在化」が起きやすいのではないかと推測した。実際に、昔のゼオライト研究者は「Al近傍に存在するカチオンがH+の場合は酸性OH基として共有結合を形成しているが、アルカリ金属交換型ゼオライトでは、アルカリ金属は格子全体の負電化によって安定化されている」というのを、口伝えで何度か耳にした。この点を明らかにするため、プロトン型ゼオライトのOH基を観測するように、アルカリカチオンと格子酸素の結合を直接観測することに挑んだ[13]。「挑んだ」というのは、[アルカリ金属]―[格子酸素]の振動は、遠赤外領域に現れることが知られており、ちょっとした工夫で克服できるような簡単な測定ではないからである。
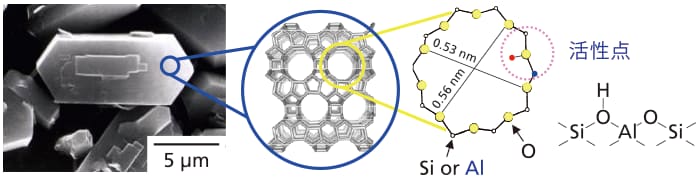
図2 H-ZSM-5 ゼオライトのSEM像と結晶構造、および活性点の構造
FT-IRのシグナル光が透過するところに存在する固体触媒上の活性種(酸性OH基など)や吸着種の密度は、気体や液体試料のそれに比べてはるかに低い。そのため通常の中赤外領域の測定であっても、様々な工夫が必要である。それに加えて、遠赤外分光が難しいのは、用いられる光源の輝度が低いことと、遠赤外領域に最適な検知器そのものと、その稼働が非常に高価であることに由来する。例えば図3で比較したように[14]、通常の熱励起光源は1127 ℃に加熱した際、中赤外領域に発光し、改良された光源においても遠赤外領域では微弱な発光となる。これを克服するために、固体表面種を遠赤外領域で観測するのにはシンクロトロン光源が用いられてきた。放射光を用いると桁違いの輝度を得ることができるが、測定系、例えば雰囲気制御が可能な閉鎖真空系や温度可変セルなどを測定場所に設置、あるいは持ち込む必要があり、大掛かりになる。一方で検知器も、汎用的な半導体検知器(MCT やInSbなど)では十分な感度がなく、通常は熱励起型TGS検知器が用いられている。しかし、固体表面種の観測ではTGS検知器では感度が十分でないため、液体ヘリウムで冷却したGe:Cu検知器[1]やSiボロメーター[2]と呼ばれる高価な検知器が用いられている。また言うまでもなく、ボロメーター自身に加えて、液体ヘリウムでの冷却実験も非常に高価になる。
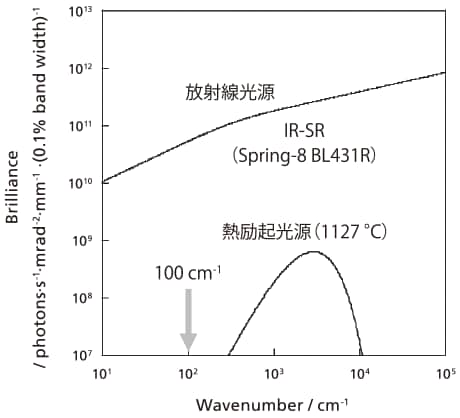
図3 放射光光源と熱励起光源の輝度の比較
固体表面に遠赤外分光法が用いられたのは、先に述べた金属単結晶表面上の吸着COの系が最初で、観測にはシンクロトロン光源とボロメーター検知器が用いられている。一般に、金属表面にIR光を反射させる際に、入射角を非常に大きくすると吸収効率が劇的に上昇し、高感度で測定ができる(赤外反射吸収法:Infrared reflection absorption spectroscopy, IRAS)[15, 16]。このため、光が反射する数mm2の表面積に存在する数少ない分子を、感度良く測定することができる。遠赤外分光法の場合は、この手法にさらに上記のセットアップを備える必要がある。したがって、平滑な金属表面とは異なり、特別な高感度を得る方法の存在しない粉体触媒上の吸着種の場合、遠赤外分光法の応用は困難に思われるが、ゼオライトのように表面積が桁違いに大きな多孔性物質の場合は、その限りではない。遠赤外分光法の観測対象になった最初のゼオライトは、Na型のZSM-5とモルデナイトの単結晶で[17, 18]、広域X線吸収微細構造(Extended X-ray absorption finestructure, EXAFS)や理論計算と合わせて、構造解析が行なわれており[17, 19]、光源は様々だが、いずれの場合も検出器にはSiボロメーターが用いられている。
触媒研究を行う上で、固体表面と吸着分子の相互作用を直接観測することは、非常に本質的で魅力的なテーマである。したがって、特別な設備を用いずに、汎用性のあるFT-IRを用いて遠赤外分光を行うことを目的に、またそれが可能であることを示すために、本研究に取り組んだ結果を下記に紹介する。
通常のFT-IR測定と同様に、5‒100 mgの粉体触媒を直径20 mmのディスクに圧縮成型し、温度可変(-180 ‒ 650 ℃)のIRセルの中心に設置した。セルは真空排気や各種吸着分子の導入が可能な系に繋がっており、測定前に加熱真空排気によって吸着水を除去した。中赤外分光では窓板にNaClやKBrを用いるが、遠赤外分光の場合、ポリエチレンの窓板を用いた。ポリエチレンの窓板は、加熱真空排気に耐える必要があるため一定の厚みを必要とするが、厚すぎると透過光量を減少させるため、2.0 mmを最適な厚みとした。なお、測定可能な温度範囲は、-100 ‒ 400 ℃である。ビームスプリッターは5 µmのマイラーを、検出器にはPE-TGSを用い、4 cm-1分解能で256回の積算を行なってスペクトルを得た。
図4の一番下のスペクトルに示した様に、カチオンがプロトンの場合(HY5.6ゼオライト)、中赤外スペクトルには酸性OH基の吸収が3547 cm-1に観測され、遠赤外領域には何も吸収を示さない。(3640 cm-1の吸収はゼオライト結晶の外表面に存在するシラノールSiOHのOH伸縮振動に帰属される。)HY5.6ゼオライトを各種アルカリイオン交換すると、H+はアルカリイオンに置換され、中赤外領域の吸収は消失する一方で、遠赤外領域にカチオンの質量によって異なる波数に吸収が観測される。赤外吸収のエネルギーは、質量m1とm2からなる二原子分子の場合、下記のフックの法則に従って、換算質量µに応じてその波数がシフトする。ここで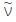 は振動数、πは円周率、kはバネ定数である。
は振動数、πは円周率、kはバネ定数である。
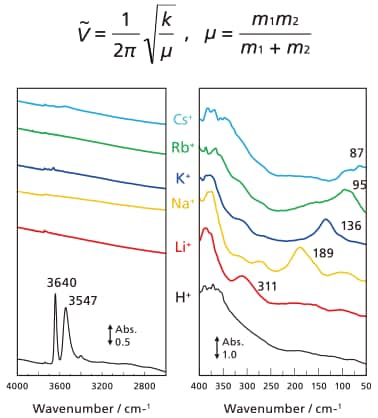
図4 アルカリ金属交換Y5.6(FAU type)ゼオライトのfar-IRスペクトル
固体上の表面水酸基を例にとると、OH 基がOD 基に同位体交換した場合、格子酸素が固定されHあるいはDのみが振動に関わっていると仮定すると1.41-1(1/√2)となる。一方で格子酸素も自由に動くことのできる二原子分子として扱うと、同位体比は1.37-1と算出される。ゼオライトの酸性OH基の場合、実測の振動波数はOH:3547 cm-1およびOD:2688 cm-1で、その比は1.32-1と、予測された波数より低くなる。すなわち、換算質量の差が計算値より小さい(HやDの換算質量への寄与が小さい)ことがわかる。このことから、固体表面種の場合格子酸素と水素のみでなく、ゼオライト骨格の質量も若干関わっていると推測される。
図4で観られた振動数に、カチオンのみが振動していると仮定した際の質量依存性を当てはめると、Hから各イオンに交換した場合、それらの吸収は1370 - 313 cm-1(Li → Cs)と計算され、実測値とは大きく外れる。そこでHを除外しNa+を基準としてフックの法則を当てはめた結果、格子酸素1つとアルカリ金属イオンの換算質量から計算した値よりもカチオン単独の質量で考えた場合に、実験結果と良い一致を示した[13]。したがって、観測された吸収は、ゼオライト格子の静電場に置かれたアルカリ金属イオンが単独で振動している状態、すなわちカチオン振動と帰属するのが妥当である(図5)。
図5 ゼオライト格子の静電場でのカチオン振動
次に、カチオンの種類を固定してゼオライトのトポロジー、すなわち細孔内の構造が異なるゼオライトについて検討した。図6に5種類のNa+交換型ゼオライトのカチオン振動を比較した。このうち、CHA型とFAU型はケージ(かご状の空間)を有する構造で、MFI型、*BEA型およびMOR型はチャンネルからなる構造を有している。カチオンの密度が多いほどスペクトルの観測がし易いため、Alの含有率の多い(Si/Al比の小さい)試料を用いた。試料によって吸収の波数(エネルギー)のみならずその数(細かいことを言えば、ピーク幅や強度なども)も異なっているが、それらの違いについては議論できるだけの十分な測定結果が得られていないので、現段階で深い考察をすることは難しい。なお、CHA型ゼオライトについてもカチオンの種類を変えて測定すると、図4に類似した結果が得られ、カチオンの質量(m)についてFAU型と同様に(1/√m) に一次の依存性を示した。したがって、FAU型に限らずゼオライト細孔内のカチオンは、近傍の格子酸素による静電場での点電荷振動であることが確認できた。また、カチオンの質量依存性((1/√m) に対する振動波数の傾き)は、FAU型とCHA型ゼオライトで異なる結果となった。このことから、細孔構造が異なると、細孔を構成している格子が作る静電場の状態が異なり、結果として静電場とカチオンの相互作用、すなわちカチオン振動のエネルギー(波数)に違いが現れていると考察できる。
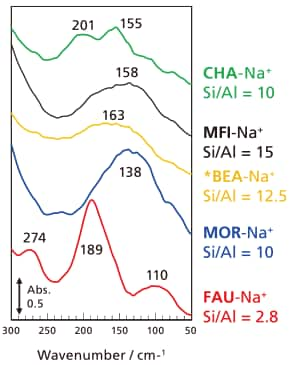
図6 Na+カチオン振動の骨格構造間での比較
オン交換型ゼオライトに関しては、加熱排気によって吸着水を除去する操作を行ったが、いわゆるIn-situ測定によって積極的に観測場の雰囲気を変化させ、それに伴うスペクトル変化を追跡したものではない。そこで分子性カチオンを用いて、加熱真空排気によるカチオン種の分解・脱離や、その後の塩基性分子の吸着を行い、観られた吸収の同定を行った。図7にNH4+体のFAU型(Si/Al = 2.8)とCHA型(Si/Al = 10)ゼオライトを様々な条件で処理した際のスペクトル変化を示した。まず、NH4+-FAUゼオライトでは70 ℃排気後に176 cm-1にアンモニウムカチオンによる吸収が観測されているが、真空排気下で250 ℃まで昇温すると、この吸収は消失した。NH4+型ゼオライトは加熱真空排気によりアンモニアが脱離し、アンモニウム型からプロトン型ゼオライトとなることが、中赤外分光法とアンモニアの昇温脱離法で確認されている。したがって、この温度で消失した吸収がアンモニウムカチオンへ帰属されることが確認された。ここへ少量のアンモニアを室温で導入すると、その導入量に応じて消失したピークが再観測され、最終的には元の状態が復元することで、上記帰属の検証を行うことができた。また、アンモニアが脱離した後にピリジンを導入すると、異なる波数(137 cm-1)に吸収が現れることから、分子性カチオンの場合もアルカリカチオンと同様に、振動吸収が観測されることがわかった。
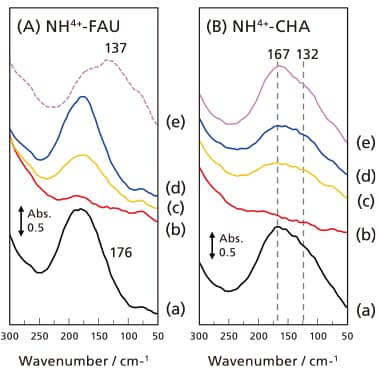
図7 NH4+型ゼオライト加熱排気処理およびNH3の再吸着やピリジン吸着を行った際の遠赤外スペクトル
(A) (a) 70 ℃真空排気、(b) 250 ℃真空排気、(c) (b) にNH3(135 Pa)を導入、
(d) (b) に NH3(540 Pa)を導入、(e) (b) にピリジン(500 Pa)導入
(B) (a) 70 ℃真空排気、(b) 250 ℃真空排気、(c) (b) にNH3(270 Pa)を導入、
(d) (b) に NH3(810 Pa)を導入、(e) (b) を100 ℃に昇温
NH3の導入にはHeの希釈(27 %)ガスを用い、スペクトルの測定はいずれも室温
次に細孔径の小さな(0.38 nm×0.38 nm)ケージ型細孔を有するCHA型ゼオライトについても同様の検討を行った(図7(B))。CHA型ゼオライトの場合も、70 ℃排気後で観られていた吸収(167 cm-1と132 cm-1)が250 ℃での真空排気により消失したが、室温でアンモニアを再導入しても完全に復活しなかった。一方で、導入したアンモニア存在下で100 ℃まで昇温するとスペクトルが復元した。これは、ゼオライト細孔の格子振動(pore mouth breathing)が100 ℃で熱励起され、実質的に細孔口径が広がったため、室温では細孔内に十分に入り切らなかったアンモニア分子が細孔内に存在する酸点(OH基)にアクセスできる様になり、元のNH4+-CHAゼオライトとなったためである。
本稿で紹介したゼオライト細孔内のカチオン振動の観測から、「Al近傍に存在するカチオンがH+の場合は酸性OH基として共有結合を形成しているが、アルカリ金属交換型ゼオライトでは、アルカリ金属は格子全体の負電化によって安定化されている」という言い伝えを実証することができた。この結果とこれまでに観測してきたゼオライトの特性と合わせて、他の酸化物の酸塩基特性と比較する。まず、プロトン型ゼオライトについてCO2をプローブとして格子酸素の塩基性を検討した結果、酸性OH基近傍のAlに結合した酸素には塩基性があることが分かっている[12]。さらにいくつかの触媒反応が、酸性OHと塩基性格子酸素のブレンステッド酸塩基ペアサイトで進行することも報告されている[8, 9]。
このことは、金属酸化物表面で金属サイトと格子酸素がそれぞれルイス酸点とルイス塩基点のペアサイトを形成し、多数の触媒反応がこの活性点で協奏的に進行することと類似している。表面OH基の移動性に関しては、酸化物表面上の孤立したOH基がおよそ600 ℃以上に加熱すると、脱水を伴って減少していくという現象から、かなり高温にすると、酸化物の表面OH基は原子状水素あるいはプロトンとなって表面を移動していることがわかる。一方でゼオライトの場合、100 ℃以上の低い温度でプロトンが移動するが[11]、これは格子酸素の負電荷が非局在化しやすく、「プロトンと骨格」という形の酸塩基対形成に起因していると考えられる。さらに、カチオン振動が室温でも観測されることも、ゼオライト上での負電荷の容易な非局在化を支持する結果となっている。通常の平坦な固体表面では、活性点同士の距離が離れているため電荷の非局在化はよほど温度を上げないと起こりにくいが、ゼオライトの様な特殊な細孔構造では、三次元空間的に観測すると活性点が密集しており、「広域にわたる電荷の非局在化」が起こりやすい。これが、ゼオライトが高い活性を示す(低い温度で反応が進行する)触媒であることの一因であると考察している。
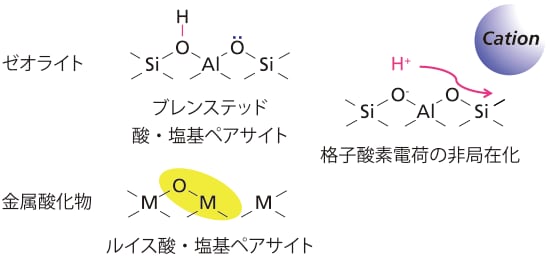
図8 酸化物固体触媒表面の活性点
実験データをまとめると、あたかも簡単に結果が出るように見えるが、実際に研究を始めてから最初のスペクトルが測定できるまでには2 年近くかかった。データに恵まれないこの研究のみに集中してると、測定者の精神衛生に良くないので、いくつかの研究を並行して進めてきた結果、他の酸塩基触媒と違って、ゼオライトがなぜ特殊なのか理解を深めることができたので、その考察を最後に記述させていただいた。遠赤外分光法を用いた研究では、まだ十分に結果が得られておらず、やり残した感は否めない。特に分子性カチオンは、質量に加えて分子内での電荷の位置も考慮しなくてはいけないため、観測結果の考察に難航した。多少心残りではあるが、今後遠赤外分光法測定が広がり、より多くの方々が研究を進めてくれることを期待している。なお、本稿で解説しきれなかったカチオン振動の詳細な解析に興味のある方は、引用文献を参照してほしい。