
お客様のご意見・ご要望のご紹介

加藤 遼 先生
大阪大学大学院基礎工学研究科 システム創成専攻 電子光科学領域 助教 (ご所属・役職は2024年9月発行時)
動物細胞や微生物の生態、またそれらが関連する数多くの生命現象を理解する上で、光を用いる光学顕微イメージング技術は重要な役割をこれまで果たしてきた。17世紀に光学顕微鏡が発明されて以降、生物の形態やダイナミクスを観察し、生命科学の発展に繋がってきた。蛍光顕微鏡の登場により、形態だけでなく、生物内の分子・オルガネラの分布を可視化できるようになり、生命科学が発展したと共に、生物内の分子イメージングの重要性を強調することにもなった。近年では、ラマン分光を用いた非染色分子イメージング技術も発達し、前処理なしで生物内の分子分布や分子の化学構造に基づく物性情報を高解像度で可視化することができる。そのため、動物細胞やバクテリア、バイオフィルムの組成分析に広く応用されている。
一方で、ラマン散乱光は微弱な光信号であるため、十分な視野と解像度を確保した顕微イメージングには数時間を要する。それゆえ、生物のダイナミクスの観察は難しい。また、自家蛍光が強い藍藻などの試料では、微弱なラマン散乱が自家蛍光に埋もれ、その計測が難しい。その点、赤外吸収分光は、ラマン分光に比べ感度が3 桁以上も高いため、高速イメージングが可能であることや、中赤外域の光信号を計測するため、可視域の自家蛍光の影響を受けない利点がある。また、振動分光学的に重要な差は、生体内の分子の極性型の分子振動を観察できる点である。生物内に存在する生体分子には、それぞれ特有の極性型の分子振動を示す官能基・分子構造がいくつか存在する。例えば、脂質のカルボニル基やタンパク質のアミド結合、多糖の骨格構造などである。これらの極性型の分子振動は、周囲もしくは分子全体の構造変化に鋭敏であるため、これらの信号を計測することで、それぞれの分子を可視化することや、タンパク質の2 次構造や官能基の変化などの分子情報も解析できる。しかし、顕微鏡の空間分解能は用いる光の波長で決まるため、フーリエ変換型赤外分光(FTIR)をベースとした赤外顕微鏡の空間分解能は20 µm 程度に制限される。細胞内の分子構造体の観察には、少なくともサブマイクロメートル程度の空間分解能が必要である。
そこで我々は、近年開発した超解像中赤外分光イメージング技術の生物計測応用を進めている[1]。先ほど述べたが、顕微鏡の空間分解能は、主に信号を読み取る際に使用する光の波長によって制限される。中赤外フォトサーマル顕微鏡は、ナノ秒パルスの中赤外レーザーを試料に照射し、分子の赤外吸収によって生じる光熱効果(試料の屈折率・体積の瞬間的な変化)を可視光で検出する技術である(図1 左)。可視光の反射光や透過光の強度および進行方向は、熱レンズ効果やMie理論に基づいて赤外吸収による光熱変換に依存する。したがって、ロックイン検出などの手法を用いてこれらの微小な変化を読み取ることで、間接的に分子の赤外吸収情報を取得できる。この手法により、蛍光やラマン顕微鏡と同等の高い空間分解能で赤外吸収情報を分析できる。我々のグループを含む国内外の数グループは、独自に中赤外フォトサーマル顕微鏡を開発してきた[2-5]。図1 中は、従来のFTIR赤外顕微鏡で取得した直径3.5 µmのポリマー粒子の赤外吸収画像と、我々の中赤外フォトサーマル顕微鏡で取得した直径0.5 µmのポリマー粒子の赤外強度画像を示している。どちらの画像も、ポリスチレンの芳香環環伸縮モードの強度(波数1494 cm-1)で可視化されている。中赤外フォトサーマル顕微鏡では、サブミクロンサイズの微小物体でも可視化でき、従来の方法と比較して空間分解能が10倍以上向上していることが、それぞれの強度ラインプロファイルからも確認できる。
中赤外フォトサーマル計測においては、FTIRスペクトルを再現できるかという議論がある。図1 右は、ポリスチレンのFTIR・中赤外フォトサーマルスペクトルである。中赤外フォトサーマル計測では、赤外パルス光の波長を掃引しながら可視光の応答を計測することでスペクトルを得る。図の2つのスペクトルの特徴がよく一致している。スペクトル形状の違いは、フォトサーマル計測では量子カスケードレーザーを光源として使用しているため、レーザーの偏光特性や強度特性がスペクトルに反映されているものと考えられる。
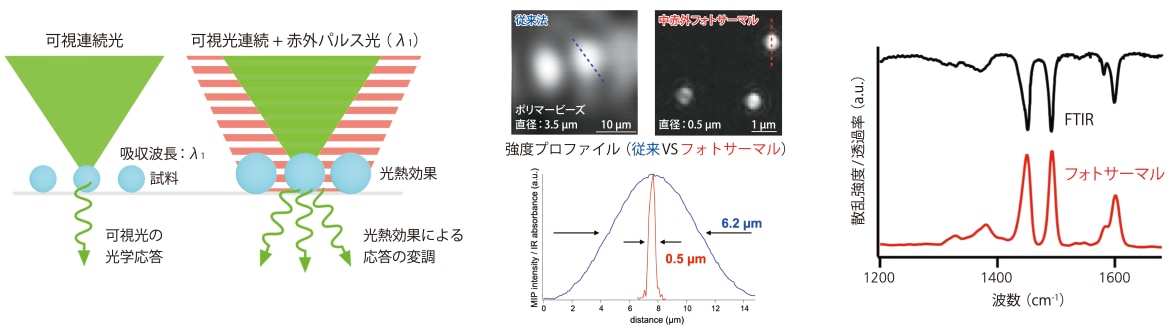
図1 (左)中赤外フォトサーマル計測(中赤外光熱変換計測)の概要
(中)中赤外フォトサーマル顕微鏡を用いたサブミクロン赤外吸収イメージングの原理実証。
従来法と中赤外フォトサーマル顕微鏡で撮像されたポリマービーズの赤外吸収像の比較。
(右)フーリエ赤外分光法(FTIR)と中赤外フォトサーマル計測で取得したポリスチレンの赤外吸収スペクトルの比較。文献1より転用。
中赤外フォトサーマル顕微鏡は、空間分解能の高さに加え、もう一つの重要な利点がある。それは、試料の蛍光が赤外吸収信号と相互干渉しないため、2つを共立化できることである。試料からの反射光や散乱光を蛍光フィルターで分光することで、蛍光信号と可視光の応答から読み出した中赤外吸収信号を個別に検出することが可能である。この特徴により、蛍光標識された試料や強い自家蛍光を持つ試料に対して、蛍光および赤外分光イメージングを同時に行うことができる。実際の応用例として、光合成微生物である藍藻と藍藻が細胞外に生成する多糖を主成分とするマトリックス構造のイメージング分析を行なった。自家蛍光を利用して藍藻を観察し、藍藻が生成する硫酸多糖の特定振動モードを用いてイメージングを行い、試料内の各成分の分布を可視化した[6]。図2 左に、藍藻と硫酸多糖の赤外吸収スペクトルを示した。硫酸多糖に含まれる硫酸基は、主にタンパク質で構成されるバクテリアとは異なる独自の赤外吸収信号を示す。この特異な波数領域を用いることで、硫酸多糖の可視化が実現できる。図2 中、右には、透明基板上に作製された藍藻バイオフィルム試料の明視野画像、硫酸多糖の赤外吸収信号強度、およびバクテリアの自家蛍光強度が示されている。このマルチモーダルイメージングの結果、バイオフィルム内で藍藻と硫酸多糖が明確に可視化できた。この観察から、バイオフィルム内の硫酸多糖が繊維状の構造を形成し、その構造に沿って藍藻細胞が整列していることが判明した。しかし、他の領域をイメージングした結果では、藍藻細胞が必ずしも繊維状構造に沿って並んでいるわけではないことも確認された。
従来の説では、バイオフィルムはブルーム状に形成されると考えられており、実際にマクロレベルでの観察でもブルーム状の形成が確認されていた。硫酸多糖の集合体が形成された後、培養液中で藍藻細胞がこれに結合し、気泡の浮力により自然に集まって密集したバイオフィルムが形成されると考えられてきた。今回のイメージング結果は、この予測が正しいことを示唆していると我々は考察している。今回は特に藍藻の硫酸多糖に焦点を当てて解析を行ったが、今後はバイオフィルムの形成や機能に関わるタンパク質や核酸など他の分子についても可視化を行う予定である。
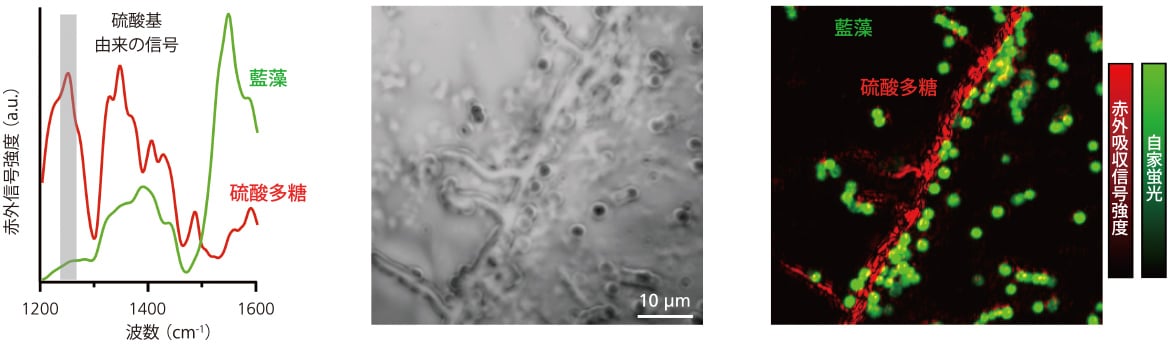
図2 藍藻バイオフィルムの超解像中赤外分光イメージング
(左)藍藻と硫酸多糖標品の赤外分光スペクトルの比較。
藍藻バイオフィルムの(中)明視野像と(右)赤外吸収・自家蛍光強度画像。
文献6より転用。Under CCBY。
本記事では、赤外分光法の生物計測への応用に関する背景とその進展について説明した。従来の赤外分光イメージングの課題を打破する超解像イメージング技術とその特徴を活かした生物計測の応用例を示した。この手法は、蛍光と赤外吸収の同時イメージングが可能であり、藍藻バイオフィルムの主要成分である藍藻と硫酸多糖を可視化することができる。その結果、バイオフィルム形成過程の分子機構に関する有力な証拠を得ることに成功した。今後は、レーザー走査光学系や情報科学的手法を導入することで、広視野かつ高速な生物分析が実現し、藍藻の硫酸多糖スクリーニングへの応用も視野に入れている。これらの技術は、藍藻バイオフィルムや硫酸多糖工学の研究の発展に寄与するだけでなく、硫酸多糖が実用化された際の工場での品質評価などのスクリーニング技術としても利用可能である。また、バクテリアや真核の微生物、植物細胞や動物細胞を広い研究対象に有効であると期待している。一方で、スペクトルの詳細な議論やFTIRと中赤外フォトサーマルの分光特性の差異については引き続き議論が必要であろう。スペクトルの定量的な議論のみであれば、現状は赤外吸収を直接計測するFTIRの方が優位である。そのため、このような超解像技術とFTIRのような装置はセットで利用する方が良いと筆者は考える。