アミノ酸の分析法
健康食品ブームで注目されている「アミノ酸」ですが,この成分を分析するのにもっともよく使われているのがHPLCです。 今回は,検出法を中心にアミノ酸の分析法について解説します。
検出法の種類
アミノ酸をUV検出するには,カルボキシル基(-COOH)の200~210nmでの吸収を利用するしかありません。 一部,ベンゼン環を持つアミノ酸は250~280nmでの検出も可能ですが,一般にはそのままの形で高感度に選択性良く分析するのは困難です。
そこで,古くから誘導体化法が使われています。 多くのアミノ酸は,その構造の中にアミノ基(-NH2,-NHR)を有しており,アミノ基に対して選択的に反応するような誘導体化試薬が用いられます。
プレカラム誘導体化法 (プレラベル法)
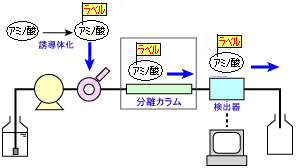
プレカラム誘導体化法
プレカラム誘導体化法は,注入する前にアミノ酸を誘導体化し,その生成物をHPLCで分離・検出する方法です。 右にその概念を示します。 右図中のラベルは,誘導体化試薬を表しています。
この方法の検出上の利点は,以下の通りです。
- 一般に,反応系を小さく設定することで試薬消費量を少なくできる
- そのため高価な試薬の使用が可能となり,(ポストカラムに比べて)低いバックグラウンドとあいまって高感度化が可能
- 仮に未反応の誘導体化試薬が検出されても,カラムで分離されれば問題ない
逆に欠点は,試料と誘導体化試薬とが直接に混合されることから,反応効率(収率)が試料マトリクス (共存成分や溶媒などの種類) の影響を受けやすいことです。 こうしたことから,プレカラム誘導体化法は,試料の種類をある程度限定した上で高感度分析を目指すのに適した方法と言えるでしょう。
アミノ酸分析用の代表的なプレカラム誘導体化試薬として,o-フタルアルデヒド,イソチオシアン酸フェニル(フェニルイソチオシアネート:PITC),フルオレサミン,ダンシルクロライドなどが挙げられます。 反応操作は様々で,室温で単に混合するだけで速やかに反応が進行するものもあれば,反応に加熱が必要なもの,反応後にクリーンアップが必要なものなどもあります。
なお,反応生成物の分離には,多くの場合逆相クロマトグラフィーが用いられます。 通常,アミノ酸のような親水性の高い物質の分離では逆相法は不向きとされていますが,プレカラム誘導体化法では,カラムへの導入以前に誘導体化によってアミノ酸に疎水性の高い官能基を修飾できるため,逆相法による分離が可能になります。
逆相法は,分離性能が高いため,条件設定次第では非常にハイスループットな分析が可能です。 下記は 高速LC Prominence UFLC と 逆相カラムShim-pack XR-ODSを用いて (PITC試薬を持ちいて)PTC化したアミノ酸を分離した例です。
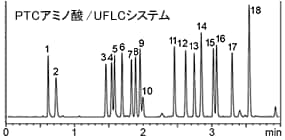
1.L-アスパラギン酸, 2.L-グルタミン酸, 3.L-セリン, 4.グリシン, 5.L-ヒスチジン, 6.L-アルギニン, 7.L-スレオニン, 8.L-アラニン, 9.L-プロリン, 10.アンモニア, 11.L-チロシン, 12.L-バリン, 13.L-メチオニン, 14.L-シスチン, 15.L-イソロイシン, 16.L-ロイシン, 17.L-フェニルアラニン, 18.L-リジン (なおPTC化反応は,塩類など試料夾雑の影響を受けますので,精製したタンパク・ペプチドの加水分解物など,限定した用途が適しています)
ポストカラム誘導体化法 (ポストカラム反応検出法)
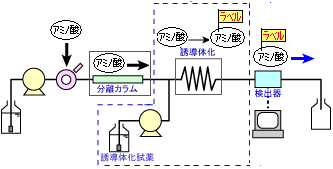
ポストカラム誘導体化法
ポストカラム誘導体化法は,カラムでアミノ酸を分離した後,誘導体化試薬を送液・混合して反応させ,最後に検出器に導く方法です。右に,その代表的な流路図を示します。
この方法の検出上の利点は,以下の通りです。
- 反応が自動化できるため,定量性・再現性に優れる
- 反応前に試料成分がカラムで分離されるため,反応効率が試料マトリクスの影響を受けにくく,広範囲の試料に適用できる
逆に欠点は,高感度化しにくいこと,反応試薬を流しっ放しなので試薬消費量が多いことなどです。
このようなことから,ポストカラム誘導体化法は,いったん反応系を最適化してしまえば広範囲の試料に適用でき,定量性に優れたルーチン分析向きの手法と言えるでしょう。
ポストカラム誘導体化では反応試薬が連続的に検出器に流れ込むため,未反応試薬は検出されてはならないという制限があり,使用できる試薬の種類が限られます。 現在アミノ酸分析用に用いられている試薬は,ニンヒドリンとo-フタルアルデヒドのほぼ2種類に限られています。 前者は可視吸光度検出,後者は蛍光検出です。
分離にもっともよく用いられるのは,陽イオン交換クロマトグラフィーです。 アミノ酸はアミノ基とカルボキシル基の両方を構造中に有する両性イオンですから,陽イオン交換では酸性の強いもの (陰イオンになりやすいもの) ほど早く溶出し,塩基性の強いもの (陽イオンになりやすいもの) ほど遅く溶出します。
ところで,現在のHPLCの主流は逆相クロマトグラフィーなのに,なぜ陽イオン交換が用いられるのでしょうか? これは,陽イオン交換を使うことにより,アミノ酸同士の分離やアミノ基含有物質(アミン類)との分離を容易に効率良く行えるからです。
親水性の高いアミノ酸は,逆相法では十分な保持や選択性が得られない可能性があります。 陽イオン交換法を使うことによって,複数のアミノ酸を効率よく分離することができます。
また,アミノ酸分析に用いられる誘導体化試薬はアミノ基に対して反応性を有するため,一般的なアミン類に対しても反応し,それらをピークとして検出してしまう可能性があります。 ところが,アミン類はほとんどの場合カルボキシル基のような陰イオン性の官能基を持たないため,アミノ酸よりは塩基性が強く,陽イオン交換においてはアミノ酸類よりも遅く溶出します。 すなわち,陽イオン交換を使うことにより,アミン類がアミノ酸の定量を妨害することがなくなるわけです。
このように,アミン類及びアミノ酸同士を分離できる陽イオン交換クロマトグラフィーと,アミノ基に対して選択的に反応するポストカラム誘導体化検出とは,まさに「理想的な結婚(?)」と言えるのです。
以下に,最近流行のアミノ酸飲料を,o-フタルアルデヒドを用いたポストカラム誘導体化法により分析したときのクロマトグラム例を示します。
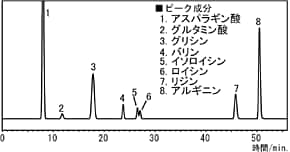
市販アミノ酸飲料の分析
アミノ酸分析における各誘導体化法の比較
| メリット | デメリット | |
|---|---|---|
| プレカラム誘導体化法 精製されたアミノ酸など,ある程度試料の種類を限定した上で高感度分析を目指すのに適した方法 |
|
|
| ポストカラム誘導体化法 いったん反応系を最適化してしまえば発酵抽出物も含めた広範囲の試料に適用でき,定量性に優れたルーチン分析向きの手法 |
|
|


