
お客様のご意見・ご要望のご紹介

本倉 健 先生
東京工業大学物質理工学院 准教授 / 科学技術振興機構さきがけ 研究者
(ご所属・役職は2019年4月発行時)
求核剤のアリル化反応(Eq. 1)は,別名「辻 -トロスト反応」とも呼ばれ,得られるアリル化生成物が種々のファインケミカルズへと変換できるため,合成化学において極めて有用な反応である,1-5)。この反応は Pd 触媒によって進行することが知られており,アリル化剤としてはアリルメチルカーボネート,ハロゲン化アリル,酢酸アリル等が用いられている。これらのアリル化剤は反応性が高いものの,脱離基(X)に由来する副生成物が,目的のアリル化生成物と当量以上生成する点に問題を抱えている(図 1)。そこで,これらのアリル化剤に代えてアリルアルコールを用いることができれば,副生成物が水のみの環境調和型合成法となる(図 1)6, 7)。さらに,従来のアリル化剤はアリルアルコールを原料として合成されているため,アリルアルコールを直接アリル化反応に用いることは,プロセス全体の簡略化にもつながる。しかしながら,アリルアルコールの水酸基(OH基)は脱離基としての反応性が極めて低いため,アリルアルコールをアリル化剤としてこの反応を効率よく進行させることのできる新たな Pd 触媒の開発が切望されていた。
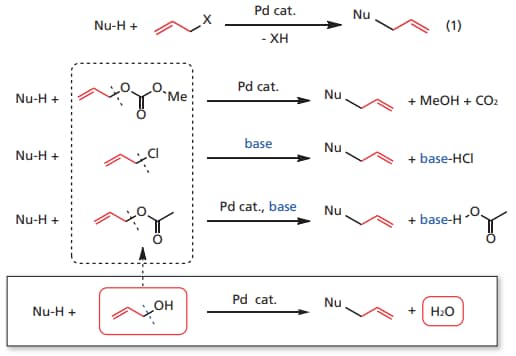
図 1 アリルメチルカーボネート,塩化アリル,酢酸アリルを用いるアリル化反応とアリルアルコールを用いるアリル化反応の副生成物比較
アリルアルコールを活性化しアリル化反応における活性中間体(π-アリルパラジウム)へ導くには,弱酸性の共触媒部位へ OH 基を求電子的に配位させ,C-O 結合の開裂を促す必要がある8-11)。そこで本研究では,シリカ表面へ Pd 錯体を固定することによって,シリカ表面のシラノール基(Si-OH 基)によるアリルアルコール OH 基の活性化と,これに続くPd 錯体との反応によるπ-アリルパラジウム中間体形成の促進を試みた(図 2)12, 13)。この Si-OH 基によるアリルアルコール活性化の過程を,in-situ FTIR 観測によって捉えることに成功した13)。
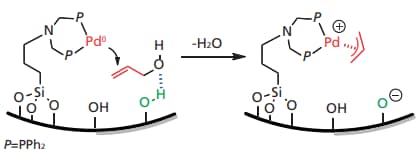
図 2 シリカ固定化 Pd 錯体と表面 Si-OH 基の協奏効果によるアリルアルコールの活性化
メソポーラスシリカ(MS)を担体とし,Pdジホスフィン錯体(PP-Pd)をシランカップリング反応によって担体表面に固定した(図 3)。固定化後の Pd 錯体の構造維持は固体13C および31P MAS NMR,Pd K-edge XAFS および元素分析測定によって確認し,Pd 錯体 がメソ細孔へ均一に分散していることをSEM-EDX分析によって確認した。
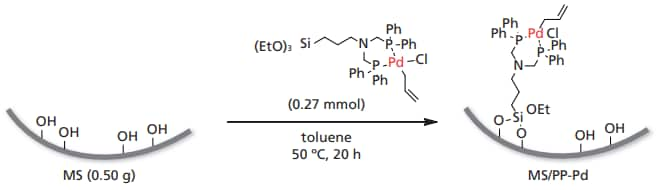
図 3 メソポーラスシリカ固定化 Pd 錯体の合成経路
図4に種々のPd触媒を用いる求核剤(1)のアリルアルコールによるアリル化反応の結果をまとめる。MS/PP-Pdを用いると,アリル化体生成における触媒回転数 (TON)87で目的の生成物が得られた。一方,MS担体を事前に焼成し表面Si-OH基量を減少させた場合(MS(cal)/PP-Pd) や,他のシランカップリング剤との反応でSi-OH基を除去した触媒 (MS/PP-Pd-cap)では,生成物収率・同一反応時間での TON の顕著な減少が確認された。加えて,触媒前駆体であるPP-Pd のみを反応に用いると,TON=10と触媒活性は極端に低下した。以上の結果は,担体の表面の Si-OH 基の存在によってアリル化反応が促進されている可能性が高いことを示している。基質 / 触媒比や溶媒の有無,添加塩基の種類など,反応条件を最適化することによって,MS/PP-Pd 触媒を用いる反応におけるPd 基準の TONは最高で 4500 に達した(収率 74%)。この値は,これまでに報告されている触媒系と比較して極めて高く,メソポーラスシリカ固定化 Pd 錯体が,アリルアルコールを用いるアリル化反応における有効な触媒であることを示している。
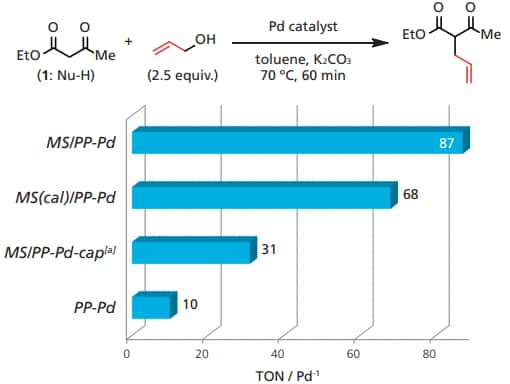
図 4 種々の Pd 触媒を用いた際のアリル化反応における触媒活性比較
[a] MS 表面の Si-OH 基をSiMe(OMe)3との反応により部分的に除去
MS 担体表面の Si-OHとアリルアルコールとの相互作用を確認するため,まず MS にアリルアルコールを吸着させた状態で固体13C MAS NMR 測定を行った。結果を図 5 に示す。64 (C1)および 137 ppm(C3)に観測されるフリーのアリルアルコールに由来するシャープなピークに加えて,66(C1’)および 136ppm(C3’)に MS に吸着したアリルアルコールに由来するブロードな信号が観測された。次に,実際の触媒 (MS/PP-Pd) とアリルアルコールとの相互作用を観測するためin-situ FTIR 測定を行った。図 6 には気相のアリルアルコール分圧を徐々に増加させながら測定した FTIRスペクトルから,アリルアルコール吸着前の MS/PP-Pd のスペクトルを差し引いた差スペクトルを示す。アリルアルコール気相分圧の増加に従って,Si-OH のO-H 伸縮振動に由来する3700 cm-1付近に負のピークが現れた。加えて,新たに生成した水素結合と思われる3200-3300cm-1と,アリルアルコールの C-H 伸縮振動による2900-3100 cm-1,C-H 変角振動に由来する1370 および 1425 cm-1に正のピークが観測された。これらの結果は,導入されたアリルアルコールの一部が MS/PP-Pd の担体表面の Si-OH 基に吸着していることを明確に示している。アリルアルコールの吸着を確認後,FTIRセルにもう一方の反応分子である求核剤(1)と塩基を加え,80 ℃で加熱後,固体サンプルを回収・トルエンで有機物を抽出し溶液をGC-MS にて分析したところ,目的のアリル化体が生成していることを確認した。この結果は,MS 表面に吸着したアリルアルコールが反応中間体となることを示しており,Si-OH によるアリルアルコールの活性化によるアリル化反応の促進を支持している。以上の結果と,反応後の触媒のPd K-edge XAFS 測定等から,固定化 Pd 錯体と担体表面のSi-OH 基の協奏的なアリルアルコール活性化によるπ-アリルパラジウム中間体の生成を経由する図 7 に示す反応機構を提案している。
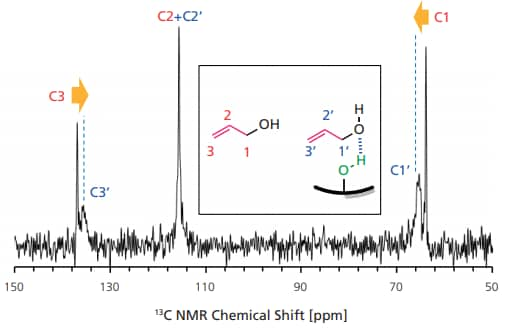
図 5 アリルアルコールを吸着させた MS の固体13C CP/MAS NMRスペクトル
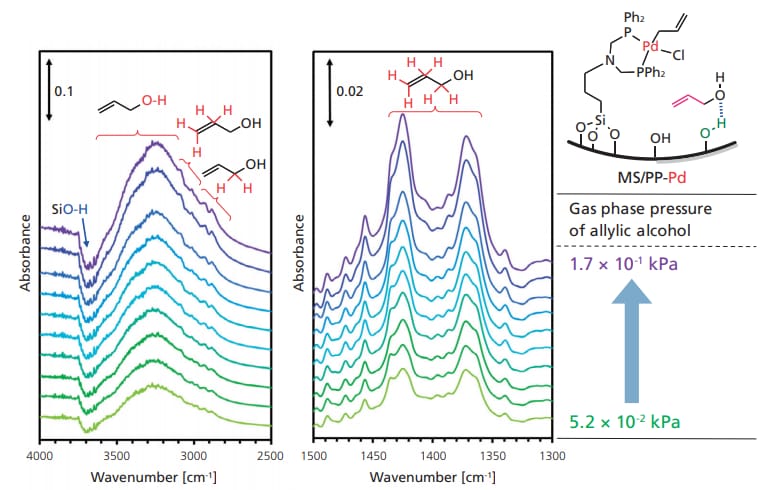
図 6 MS/PP-Pd 触媒へのアリルアルコール吸着 FTIRスペクトル
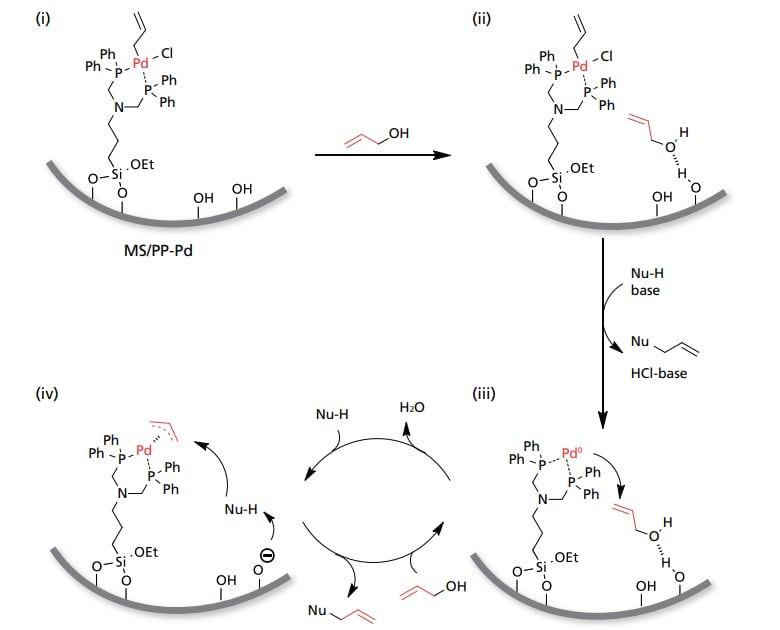
図 7 MS/PP-Pd 触媒によるアリルアルコールの活性化を経由するアリル化反応機構
メソポーラスシリカ固定化Pd錯体がアリルアルコールをアリル化剤とする環境調和型アリル化反応に極めて高い活性を示すことを見出した。Pd錯体と表面Si-OH基との協奏的なアリルアルコールの活性化によって,反応性の低いアリルアルコールを用いても本触媒系では反応が効率よく進行する。Si-OH基によるアリルアルコールの活性化の過程をin-situ FTIR測定によって明らかにすることができた。固体表面において特異的に形成される活性点ペアを活用することで,これまで難しいとされてきた触媒反応の促進が可能であり,それらの反応過程をFTIRを始めとする種々の分光学的手法を用いて観測・理解することで,さらなる高性能触媒の設計へと展開していく。
本稿で紹介した研究成果は,池田まりか氏,南保雅之氏(東京工業大学物質理工学院),Kim Minjune 博士,中島清隆准教授(北海道大学触媒科学研究所)の協力のもとに得られました。心より感謝申し上げます。