PPSQ-51A/53A
プロテインシーケンサ
プロテインシーケンサの原理
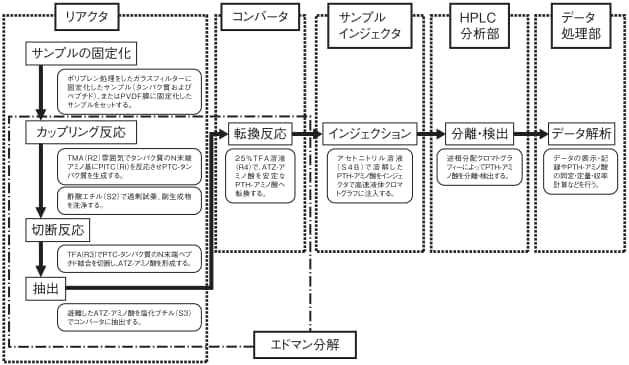
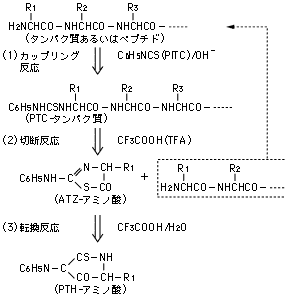
プロテインシーケンサは,1950年に Pehr Victor Edmanにより開発されたエドマン反応の自動化を試みた装置であり,その反応系は次の3つのステップに分けることができます。
[1]カップリング(Coupling)
反応槽(リアクタ)において塩基性雰囲気下で単離精製された試料タンパク質(ペプチドを含む)のN-末端アミノ基にPITC(Phenyl isothiocyanate)を結合させます。
[2]切断(Cleavage)
酸性条件でPITCの結合したN-末端アミノ酸を切断し,アニリノチアゾリノン(Anilinothiazolinone: ATZ)誘導体として有機層に抽出します。
[3]転換(Conversion)
有機溶媒を揮発させ,抽出されたATZ誘導体を酸性水溶液中でPTH(Phenylthiohydantoin)アミノ酸と呼ばれる更に安定な誘導体に導きます。
[1]でリアクタに残されたタンパク質にPITCを反応させ,以上のステップを繰り返すことにより,順次N-末端アミノ酸のPTH誘導体が得られ,これをクロマトグラフィにより同定すれば試料タンパク質のアミノ酸配列を知ることができます。
※アミノ酸配列分析のフローチャートとエドマン反応について下記に示します。
エドマン反応によりアミノ酸配列を決定するには,高度に単離精製されたpmolレベルのタンパク質試料が必要ですが,操作は非常に簡便です。例えば,電気泳動後に分離されたタンパク質をPVDF膜上に電気的に転写(Electro Blotting)し,染色後膜上のタンパク質スポットを切り取り,直接リアクタに置くだけで,以降は完全な自動分析を行う事ができます。
プロテインシーケンサの特長として,次のようなものがあり,基礎研究分野以外にタンパク質医薬品の品質管理など高度な信頼性が求められる場合には特に必須の装置となっています。
■ 決定された配列の信頼性が非常に高く,確実なアミノ酸配列決定が行える
■ タンパク質をそのまま分析可能である
■ まったく同じ質量数を有するIleとLeuを区別できる
■ S-S結合の有無とその位置が決定できる
■ 操作が極めて容易である


