
お客様のご意見・ご要望のご紹介

山田 鉄兵 先生
東京大学 大学院理学系研究科 化学専攻 教授 (ご所属・役職は2023年4月発行時)
持続可能な社会の構築のため、エネルギーの効率的な利用が重要となっている。現状では一次エネルギーの60%以上が廃熱として捨てられており、この熱エネルギーの回収は大きな課題である[1]。特に100 ~ 200 ℃の中温域の廃熱は利用が困難なため、産業界から豊富に排出されるにもかかわらず回収されずに無駄になることが多い[2]。熱電変換は廃熱利用の1つのオプションであり、様々な研究がなされている。従来のBi2Te3などの半導体熱電変換素子を用いたものに加え、最近、高いゼーベック係数(Se)を示す熱化学電池が注目されている[3]。熱化学電池は酸化還元活性を有する物質の溶液を用いる熱電変換技術である。酸化還元活物質は溶液中で平衡状態にあり、温度の上昇に伴ってエントロピー的に有利な方へと平衡が移動する。最も広く研究されている酸化還元物質がヘキサシアノ鉄(III)および(II)イオン [Fe(CN)6]3-/4-である。ヘキサシアノ鉄イオン中の鉄イオンの価数はII価とIII価で可逆に変化し、それに伴ってイオンの価数が-4 ないし-3と変化する。電荷の絶対値が大きいイオンほど強く溶媒和されるため、エンタルピー的に安定化する一方、電荷の絶対値が小さければエントロピー的に有利になる。そのため、この[Fe(CN)6]3-/4-の水溶液に2本の電極を挿入し、電極間に温度差を与えると、高温側ではFe(CN)6]3-へ平衡がシフトして酸化反応が起こり、低温側では逆に[Fe(CN)6]4-へと還元される。これにより一種の電池として振る舞い、システム全体としては熱を電気エネルギーに変換できる。
熱化学電池の溶媒として最も広く用いられているのは水だが、100 ℃以上での利用はできない。中温熱回収のためには、約200 ℃の高温で安定な溶媒が要求される。これまでにイオン液体やメトキシプロピオニトリル(MPN)DMSO、γ- ブチロラクトンなどの高沸点有機溶媒を用いた熱化学電池が報告されている[4,5]。これらの溶媒は熱安定性が高く、揮発性も無視できるので中温の廃熱利用には適している。また中温熱源を用いると大きな温度差を利用できるため、単セルあたりの出力が大きいという利点もある。中でもイオン液体は熱安定性が良く揮発性が低いために中温域での利用には最適と考えられるが、水系熱化学電池に比べてSe が低い場合が多い。熱化学電池の単位温度差当たりの電圧であるSeは、以下の式に示すように酸化還元反応の反応エントロピーΔSrcに比例することが知られている。
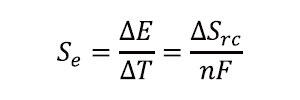
ここでΔEは開放電位、ΔT は温度差、ΔSrcは酸化還元種の部分モルエントロピー変化(酸化還元反応エントロピー)、nは反応に関与する電子数、Fはファラデー定数である。すなわち、Seの大きな熱化学電池を作成するためには、酸化還元反応によるエントロピー変化が大きいことが求められる。これまでの研究から、酸化還元反応を介した溶媒分子の再配向エントロピーが熱化学電池中における酸化還元反応エントロピー変化の主要な成分であることが示されている。イオン液体は溶液中でも構造化されていることが知られており、酸化還元反応に伴う秩序の変化ΔSrcが小さく、Seが大きくならないと考えられている。
そこで我々はイオン液体に代わり、広い動作温度範囲と高い酸化還元反応エントロピーとを併せ持つ熱化学電池向け電解液を探索し、深部共晶溶媒(DES)に着目した。DESは、有機塩と水素結合供与体の共晶混合物であり、DESの融点(共晶点)は、DESを構成する各成分よりも著しく低い ことが特徴である[6,7]。DESの融点が低下するのは、水素結合供与体がイオン種と錯体を形成し、錯体中のイオン電荷の非局在化を促進するためと考えられている。そのため、例えば融点が302 ℃の塩化コリンと133 ℃の尿素との混合物が室温で液体となる。
我々は、塩化コリン(ChCl)とエチレングリコール(EG)の1:2混合物からなるDESの1つを用いた熱化学電池を作成した[8]。このDESはエタリンと呼ばれ、広い温度範囲(-68 ~ 210 ℃)で熱安定性を示し、水酸基の存在により内部秩序が低い[9,10]。よって酸化還元対の価数の変化に伴って大きなエントロピー変化が期待できる。また計算化学による研究では、小さく、対称性が高くて分岐のないカチオンおよびアニオンからなるイオン液体を用いることでゼーベック係数が向上すると予測されている。そこで比較的小さく分岐していないカチオンであるコリンと硬いアニオンである塩化物イオンで構成されており、これが高いSeを導くとも期待される(図1)
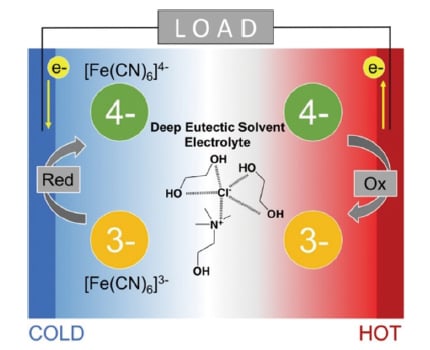
図1 エタリンを電解質として用いた[Fe(CN)6]3-/4-熱化学電池の模式図。
高温側では、エントロピー駆動の反応である [Fe(CN)6]4-から[Fe(CN)6]3-への酸化反応が優位となる。逆に低温側では、エンタルピー駆動の還元反応が促進される。これにより、電池に電位差が発生し、電気エネルギーを取り出すことができる。エタリンは広い温度範囲で熱的安定性を示すため、この熱化学電池は高温で動作させることができる。また溶媒和エンタルピーの変化が大きいため、高いゼーベック係数が得られる[8]。
エタリンに[Fe(CN)6]3-/4-を溶解した化学電池を構築し、Se測定を行ったところ、-1.67 mV K -1という値が得られた(図2a)。
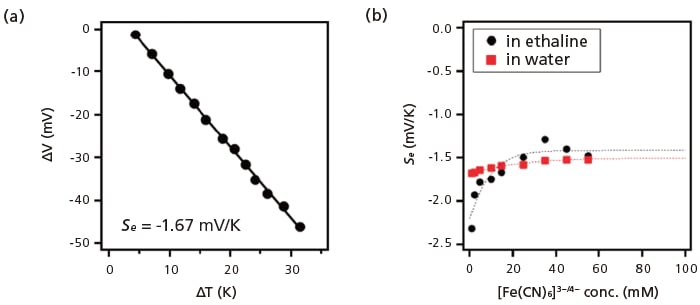
図2 エタリン熱化学電池のゼーベック係数。
(a) エタリンを溶媒とし、15 mM の[Fe(CN)6]3-/4-を加えた熱化学電池の開放電圧の温度依存性。高温側の電極は約165 ℃に固定している。
(b) エタリン熱化学電池(黒丸)と水を用いた熱化学電池(赤丸)のSe の濃度依存性[8]。
エタノールアミン熱化学電池のSeが高いのは、上述の通り[Fe(CN)6]3-/4-間の溶媒和エントロピー変化が大きいためと考えられる。[Fe(CN)6]4-は [Fe(CN)6]3-に比べて表面電荷密度が高く、溶媒分子の配向を規制すると報告されている[11‒13]。そこで実際にこれらの酸化還元種の溶媒和効果をFT-IR測定により評価した。
エタリン中では [Fe(CN)6]3-のC≡N 伸縮振動のピークの半値幅は9.8 cm-1であったのに対し、[Fe(CN)6]4-のC≡N伸縮振動ピークの半値幅は22.5 cm-1と幅広い(図3a)。これは、[Fe(CN)6]4-とエタリンとの水素結合相互作用がより強いためである。計算化学的手法により、[Fe(CN)6]3-に比較して[Fe(CN)6]4-の水との溶媒和は強いことが報告されており、これは[Fe(CN)6]4-のII価の鉄イオンからシアノ基へのπ逆供与が強く、シアノ基がより電子豊富になっており、水との水素結合が強くなっているためと考えられる。また溶媒和の分布も大きいことが示唆されており、これがFT-IRスペクトルのブロードニングに寄与していると考えられる。よって、[Fe(CN)6]4-は[Fe(CN)6]3-よりも強固な溶媒和を構築しており、その差が酸化還元による大きなエントロピー差となり、エタリン熱化学電池の高いSeに反映されていると考えられる。
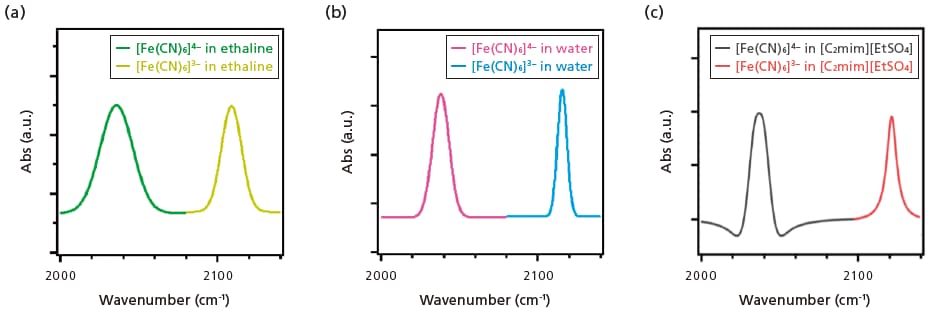
図3 エタリン(a)、水(b)、および[C2mim][EtSO4](c)中における[Fe(CN)6]3-/4-のFT-IRスペクトル。
[Fe(CN)6]3-/4-の濃度はいずれも15 mMである[8]。
FT-IR のピークの半値幅は溶媒によっても異なる。水中での[Fe(CN)6]4-と[Fe(CN)6]3-の半値幅はそれぞれ12.6 cm-1と7.4 cm-1であった(図3b)。水中での半値幅の差(5.2 cm-1)は、エタリン中の差(12.5 cm-1)より小さく、エタリンでは水に比べて溶媒和相互作用が大きいためにSe はエタリン中で大きいと考えられる。イオン液体である[C2mim][EtSO4] においては[Fe(CN)6]4-と[Fe(CN)6]3-とのピークの半値幅の差はさらに小さく(4.8 cm-1)、ゼーベック係数もより小さい(図3c)。
Seの濃度依存性を図2bに示す。エタリン熱化学電池のSeの絶対値は、溶質濃度の上昇とともに減少していることがわかる。溶媒和エントロピーはDebye-Huckel則に基づくと電解質濃度の平方根に比例するため、理論的にはSe も酸化還元対の濃度の平方根に比例する。エタリン熱化学電池で観察されたSeの濃度依存性は、これまでに報告されている水系やイオン液体系の熱化学電池で観察された傾向と同様である。しかし、エタリン熱化学電池では、Seの濃度依存性が水系熱化学電池よりも顕著であった。これは、エタリンが水系電解質中の溶媒和環境と異なる溶媒和環境を呈していることを示唆している。
酸化還元種の濃度が溶媒-溶質間に形成される水素結合の程度に影響すると推測されるため、次にエタリン媒体中の様々な濃度の[Fe(CN)6]3-/4-の溶媒和環境をFT-IR 分光法で調べた(図4)。C≡N 伸縮振動は、静電相互作用や水素結合に鋭敏に応答するため、異なる溶質濃度での挙動を調べることで[Fe(CN)6]3-を取り巻く溶媒和構造を調べられる。エタリン電解質(図4a、4b)では、[Fe(CN)6]3-濃度の増加によりC≡N 伸縮ピークのブルーシフトが見られた。このブルーシフトは、[Fe(CN)6]3-の濃度の増加に伴って、エタリンと[Fe(CN)6]3-間に形成される水素結合の数が増加するためと考えられる。一方、水溶液ではIRピーク波長のシフトがほとんど観測されず(図4e、4f)、酸化還元種と水の間の水素結合は溶質の濃度に影響されないことが示唆された。すなわち、[Fe(CN)6]3-の導入により、エタリンの溶媒分子間の水素結合ネットワークが破壊され、これにより水素結合供与体であるエチレングリコールが溶質と容易に相互作用することができる。エタリンは、エチレングリコールの水酸基、コリン、トリメチルアンモニウム基など様々な官能基からなり、それらが様々な溶媒-溶質相互作用を形成し、ひいてはレドックスカップルを取り巻く溶媒和構造を変化させる可能性がある。エタリンでは水素結合の形成がより容易に起こるため、水と比較してこの溶媒中での変化がより顕著になると思われる。その結果、図2bに示すように、[Fe(CN)6]3-のSeはレドックス対の濃度変化に伴って大きく変化したと考えられる。
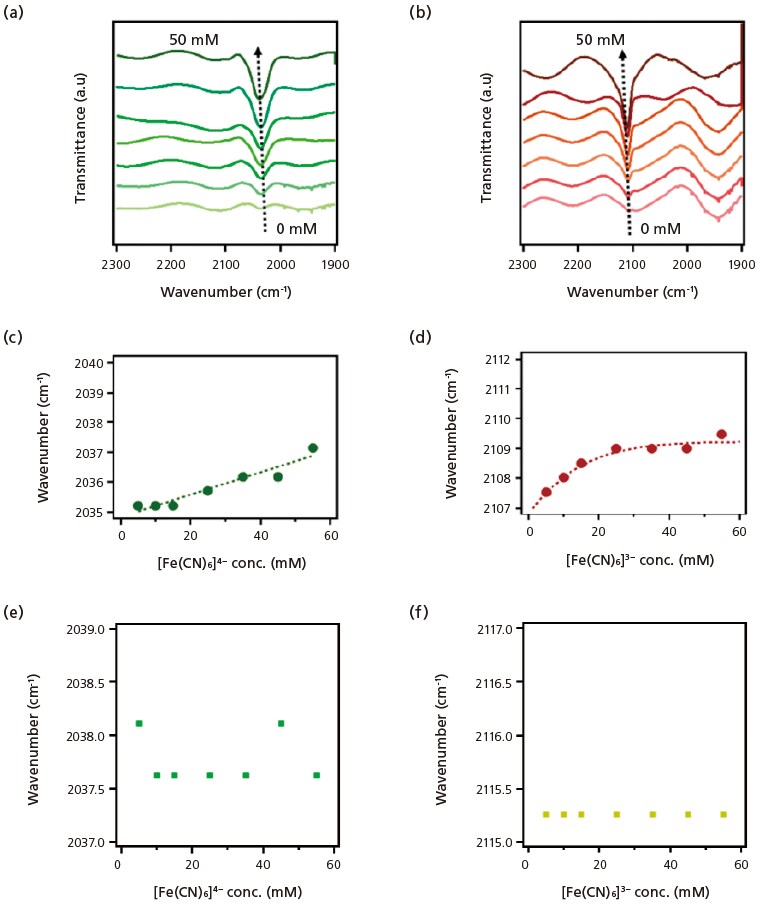
図4 エタリン中の [Fe(CN)6]4-(a)および [Fe(CN)6]3-(b)の FT-IR スペクトル。
それぞれのC≡N 伸縮振動ピークを pseudo-Voight 関数によりフィッティングし、ピーク波数を電解質濃度に対してそれぞれ(c)および(d) にプロットした。(e)および(f)には比較のために水中での[Fe(CN)6]4-および[Fe(CN)6]3-の波長シフトの濃度依存性を示した[8]。
我々は[Fe(CN)6]3-/4-酸化還元カップルとエタリンDES を電解質として用いた新しい熱電変換システムを開発した。この熱化学電池は-1.67 mV K -1という高いゼーベック係数を示し、160 ℃以上の高温で動作可能である。この高いゼーベック係数は、酸化還元種間の大きなモルエントロピー差に起因しており、FT-IR 測定により溶媒和構造の影響を見いだすことに成功した。さらに、エタリン熱化学電池は高い出力を示し、この新しい熱化学電池システムの全体的な性能の高さを示している。この高いゼーベック係数と動作温度の柔軟性は、DESを用いた熱化学電池による中温廃熱回収の可能性を示している。