無機陰イオンの検出法
電気伝導度検出法
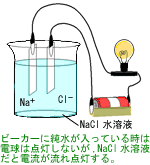
無機イオン分析には,イオンクロマトグラフが広く使われますが,その代表的な検出法が電気伝導度検出法で,イオンの持つ電気伝導性を利用した方法です。
水溶液中の一対の平行平板で構成された電極に電圧を印加した時,電極間にイオンが存在すると電流が流れます。その電流を測定することで,電気伝導度は求められます。
分離カラムの出口から検出器へ流入する移動相中に試料由来のイオン成分が含まれる場合,その領域ではイオンの濃度変化により電気伝導度の変化が発生します。 この変化を検出する検出器が電気伝導度検出器です。水溶液中でイオンとして存在しているものすべてが検出対象となります。
それぞれのイオンは,当量電導度と呼ばれる固有の定数を持っており,この数値が大きいほど,大きなピークとして検出されます。単位はS・cm2/molで表され, 1 molあたりの電流の流れやすさを表しています。
電気伝導度検出法には,ノンサプレッサ方式とサプレッサ方式の2種類の方式があります。ここでは陰イオン分析を例にして検出法を説明します。
1) ノンサプレッサ方式
陰イオン分離カラムの出口に直接,電気伝導度検出器を接続する方式です。
試料中の陰イオンは,分離カラムで陰イオン交換して保持されるため,試料中の陽イオンと分離されます。この過程で試料中の陰イオンの対イオンは溶離液中の陽イオンとなります。また,この領域ではイオン交換のため溶離液中の陰イオン濃度は減少します。
電気伝導度検出器では,試料中の陰イオン,溶離液中の陰イオン,陽イオンの3種類のイオンすべての電気伝導度の和として検出されます。(図1a)このため,使用する溶離液には低濃度で溶出力が高い有機酸系の水溶液が用いられます。
この方式では,電気伝導度検出器さえあれば通常のHPLC装置で無機陰イオンの分析が可能になります。
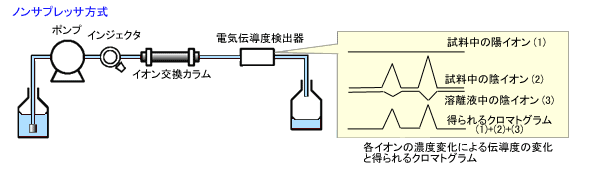
図1a. ノンサプレッサ方式
(2)サプレッサ方式
溶離液組成を電気伝導度の小さい組成に変化させる方式をサプレッサ方式と呼んでいます。
溶離液には炭酸ナトリウム水溶液などが用いられます。陰イオンを分離するときには,ナトリウムイオンの存在により溶出イオンである炭酸イオンを生成し,検出器の手前でナトリウムイオンを除去することで,溶離液は弱酸の炭酸水に組成が変化し,電気伝導度が低くなります。
一方,試料中の無機陰イオンが溶出する領域では,電荷のバランスを保とうとして炭酸の解離平衡状態が,対イオンとなるH+を生成する方向にシフトします(図中溶離液中H+クロマトグラムを参照)。水素イオンは他のイオンより当量電気伝導度が大きいため,ピークレスポンスが増大します。(図1b)
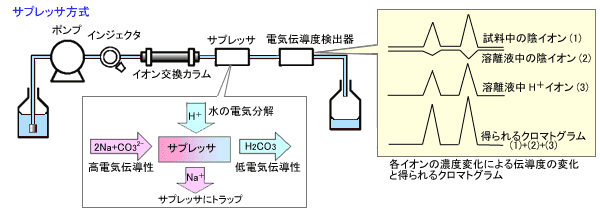
図1b. サプレッサ方式
前述のように,サプレッサ方式陰イオン分析では,(1)バックグラウンドの低減(2)ピークレスポンスの増大により感度が向上します。
陽イオン分析について,溶離液中の対イオン(OH-)の当量伝導度が水素イオン(H+)の当量伝導度ほど大きくないのでサプレッサ方式により,ピークレスポンスの増大はほとんどありません。補足:陽イオン分析のサプレッサ方式でピークレスポンスについて
| ノンサプレッサ方式とサプレッサ方式の使い分け イオンクロマトグラフでは,無機イオンばかりではなく,有機酸や疎水性の異なるイオンなども検出可能です。様々な物質が検出できるので,目的成分が夾雑成分と重ならないように分離条件を決定する必要があります。ノンサプレッサ方式とサプレッサ方式は,使用する移動相pHの違いがあり,これがイオンの分離に大きく影響する場合があります。 サプレッサ方式では,炭酸ナトリウムや水酸化ナトリウムを溶離液とするため,pH7以上の塩基性条件で分離することになります。また,この溶離液がサプレッサを通過することで,炭酸水や水に組成変化し,検出器では弱酸性から中性条件でイオンが検出されます。一方ノンサプレッサ方式では,一般に弱酸から中性の溶離液条件で分離し,そのままの溶離液組成で検出器を通過します。検出されるイオンは,分離から検出時まで同じ溶離液組成中に存在することになります。 このように,ノンサプレッサとサプレッサ方式では,分離と検出の考え方が異なるため,溶離液のpHが大きく異なります。これが,同じ試料を分析した場合でも,まったく異なった分離パターンを得ることができる理由です。 |
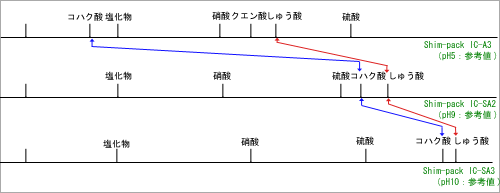 図2. 溶離液pHと有機酸の溶出 |
| 図2に溶離液pHと有機酸の溶出位置の関係を示します。ノンサプレッサ方式(図2の上段)とサプレッサ方式(図2の中段,下段)では,使用する溶離液のpHが大きく異なるため,分離時の有機酸の解離状態も大きく変化し,溶出位置が変化しているものがあることがわかります。 一方の検出方式では,困難であった夾雑成分との分離が,もう一方の検出方式でまったく問題なく分離できる場合もあり,分析法のバリエーションの一つとして,二つの検出方式を位置づけることができます。 |
参考:製品情報 イオンクロマトグラフ
直接吸光度検出法
無機陰イオンの中にも紫外域の波長で吸収を持つものがあります。亜硝酸イオン,臭化物イオン,硝酸イオンなどは210 nm付近の波長で検出が可能ですが,190 nm付近では,さらに塩化物イオンなども検出が可能です。ただし,ノンサプレッサ方式で使用される有機酸系の溶離液の場合には,溶離液自体がこの210 nm付近の波長領域で吸収を持つため利用できません。サプレッサ方式で用いられる吸収の少ない炭酸系溶離液との併用が一般的です。
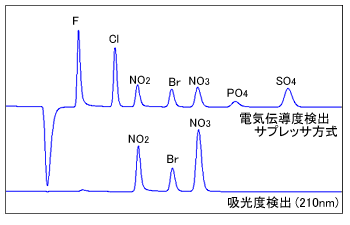
図3. 電気伝導度検出と直接吸光度検出の例


