2.2. PCI (Positive Chemical Ionization)
2.2.1. PCIの特長
PCIでは,GCから溶出される試料化合物は,試薬ガスから生成される反応イオンとの分子‐イオン反応によりイオン化されます。フラグメントイオンが少なく,分子量を測定するのに有効です。
PCI には次のような特長があります。
| (1) | フラグメンテーションが少ないソフトなイオン化 PCIは,フラグメントイオンの少ないソフトなイオン化法です。 |
| (2) | 分子関連のピークが比較的強いので,化合物の分子量決定に有用 PCIスペクトルはプロトン化分子やアダクトイオンが付いた分子イオンのような分子関連のピークが強く現れます。このピークは化合物の分子量を決定するのに有用なイオンです。 |
| (3) | イオン化には試薬ガスが必要 メタン,イソブタンやアンモニアといった試薬ガスが使用されます。 |
| (4) | 閉鎖型のイオン源を使用 閉鎖型のイオン源が使われます。 |
2.2.2. PCIスペクトル
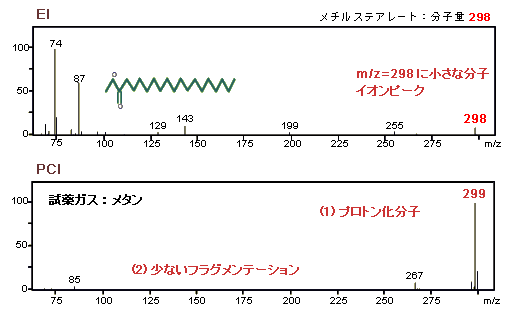
分子イオンピークは分子量を決めるのに重要です。しかし,EIスペクトルでは分子イオンピークはしばしば非常に小さく,分子量の決定が難しいことがあります。
EIスペクトルと違い,PCIはフラグメンテーションが少なく,強い分子イオン関連ピークを生じます。試薬ガスとして,メタンやイソブタンを使用すると,普通,質量M+1のプロトン化分子を生じます。ここで,Mは分子量です。
例えば,メチルステアレートのPCIスペクトルのベースピークはm/z=299です。つまり,メチルステアレートの分子量298に水素の質量1を加えたものになっています。
2.2.3. PCIの条件
PCIに必要な条件は,以下の通りです。
| (1) | イオン源に試薬ガスを導入する必要があります。試薬ガスとしては,普通,メタン,イソブタンやアンモニアなどが使われます。 |
| (2) | イオン源内の圧力は約 10 から 100Paです。これを実現するためにPCIのイオン源はほとんど閉じた構造になっています。 |
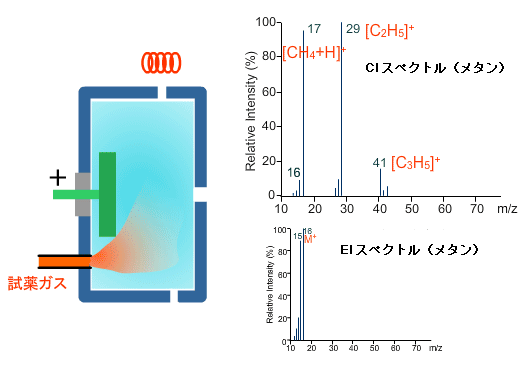
メタンのEIスペクトルのベースピークはm/z 16です。しかし,PCIの条件化でのスペクトルはEIのスペクトルとはまったく異なったパターンを示します。すなわち,多くの複雑なイオンが生成されています。PCI で観測される試薬ガスのスペクトルEIのスペクトルと似ていたら,イオン源の取り付けが適切かどうか,十分な試薬ガスが入っているかを確認したほうがいいかもしれません。
2.2.4. PCIのイオン化プロセス
PCIのイオン化は次の3つのステップから構成されています。
(1) 試薬ガスがEIでイオン化されます。
(2) (1) で生成されたイオンと試薬ガス分子との反応で反応イオンが生成されます。
(3) 試料と反応ガスとの反応で試料がイオン化されます。
PCIのイオン化プロセス(試薬ガス:メタン)
PCIでは,試料は反応イオンとの分子‐イオン反応でイオン化されます。試薬ガスとしてよく使われるメタンを例にして,PCIのイオン化プロセスを説明します。
| (1) | EI(メタン) まず,試薬ガスがEIイオン化されます。 CH4+ e → CH4+, CH3+.... |
| (2) | 反応イオンの生成 上記イオンが試薬ガス分子と反応し,反応イオンが生成されます。 CH4++ CH4→ CH3+ CH5+,CH3++ CH4→ H2+ C2H5+,... |
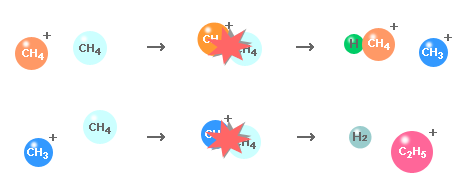
| (3) | 試料のイオン化 試料分子が反応分子と反応し,試料がイオン化されます。 M + CH5+→ [M+H]++ CH4, M + C2H5+→ [M+C2H5]+,.. |
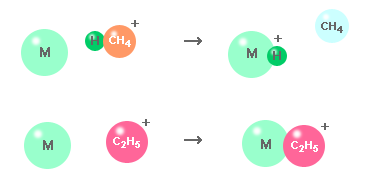
2.2.5. イオン分子反応
PCIでは,試料は反応イオンと様々な方法で反応し,イオン化されます。いくつかの重要な反応をまとめておきます。
プロトン移行
PCIの主要反応。プロトン(水素イオン) H+が反応イオン[BH]+から試料分子 M に移動し,プロトン付加分子[M+H]+を生成。
| M + [BH]+→ [M+H]++ B |
反応イオンの付加
反応イオンX+が試料分子に付加され,付加イオン [M+X]+を生成。
| M + X+→ [M+X]+ |
水素化物の引き抜き
水素化物イオンが試料分子から引き抜かれ[M-H]+を生成。
| M + [BH]+→ [M-H]++ BH2 |
電荷交換
反応イオン[BH]+と試料分子M間で電荷を交換。
| M + [BH]+→ M+.+ BH. |
2.2.6. プロトン親和力
プロトン移行はPCIではもっとも重要な反応の1つです。この反応で作られるプロトン化分子は,分子量決定に用いられます。分子にプロトンが付加しやすいかどうかは,プロトン親和力が目安になります。
プロトン化
| M + [BH]+→ [M+H]++ B |
分子Mのプロトン親和力PA(M)が,分子Bのプロトン親和力 PA(B)よりい大きい場合,上の反応が可能である。つまり, [M+H]+の内部エネルギー
| Eint(M+H)= PA(M) - PA(B), |
CH5+のプロトン親和力は130.5 kcal/molなので,PA(M) > 130.5 kcal/mol の分子MはCH5+イオンとの反応でM+1のイオンが形成される可能性がある。一般に有機化合物の多くは180 kcal/molより大きなプロトン親和力を持っているので,メタン試薬ガスではM+1のイオンが生成されやすい。
|
Note : |
2.2.7. 試薬ガス
多くの有機化合物は180 kcal/molより大きなプロトン親和力を持っています。つまり,試薬ガスとしてメタン(CH4) を使用すると,多くの有機化合物のPCIイオン化が可能になります。 試料分子のプロトン親和力が試薬ガスのプロトン親和力と比べ,非常に大きくなると,プロトンは大きなエネルギーを持って試料に移行されることになり,試料分子のPCIスペクトルはややフラグメンテーション気味になります。
イソブタンも,非常に小さなプロトン親和力を持つ試料分子を除けば多くの分子に適用でき,メタンよりソフトにイオン化できるので,よく使われます。
アンモニアもソフトなイオン化が可能ですが,プロトン化イオン以外に付加イオン [M+NH4] が生成されます。このガスを使用する場合は真空系のメンテナンスを他のガスより頻繁に行ってください。
| 試薬ガス | 反応イオン BH+ | プロトン親和力 PA(B)(kcal/mol) |
試料イオンの形態 |
| CH4 | CH5+ C2H5+ |
130.5 163.5 |
[M+H]+, [M+C2H5]+ |
| i-C4H10 | C4H9+ | 196.9 | [M+H]+, [M+C4H9]+ ( [M+C3H3]+, [M+C3H5]+, [M+C3H7]+) |
| NH3 | NH4+ | 205 | [M+H]+, [M+NH4]+ |


