電子記録(ER)と電子署名(ES)について
電子記録(ER)と電子署名(ES)について
ER/ES関連規制は,ペーパーレス化による省資源,省スペース,輸送コストの削減やコンピュータシステムによる業務の効率化を目的としたものです。 FDA 21 CFR Part 11は1997年8月20日より,日本版ER/ES指針(医薬品等の承認又は許可等に係る申請等における電磁的記録及び電子署名の利用について)は2005年4月1日より導入されました。 これらの規則には,従来GLPやcGMPで要求されてきた紙の記録(データ)とそこに施された手書き署名の代わりに,電子記録と電子署名を用いる際の要求事項が記載されています。
電子記録と電子署名はその運営次第では紙の記録と手書き署名に比較して容易に痕跡を残さず記録を改ざんできる可能性が考えられるため,この点を克服し記録の信頼性を確保することが重要視されています。
■ 電子記録とは
FDA 21 CFR Part 11では「電子記録とはコンピュータシステムにより作成,修正,維持,保管,復元および配布されるデジタル形式の文章,図,記録,音,画像およびその他の情報表示のあらゆる組み合わせを意味する」と定義されています。 ただし,2003年9月に出されたファイナルガイダンスで,対象となる電子記録の範囲を狭義に解釈するとの方向性が示されました。
分析機器用ワークステーションで自動生成されたデータは,通常,一部の情報を抽出して紙に出力し,紙の記録として利用されることがありますが,データ自動生成後に再解析をするなど自動生成されたデータを利用する作業を行うことが多いため,ER/ES関連規制の対象となります。 ワークステーションで自動生成されたデータを紙に出力して,押印により承認するなどデータに関するすべての作業を紙に出力されたデータのみで行う場合は,ER/ES関連規制の適用外となりますが,そのような運用は不可能な場合が多く,多くの場合はER/ES関連規制の対象となります。
■ 電子署名とは
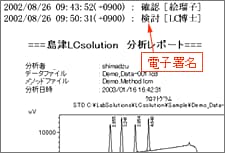
電子署名とは,「手書きの署名と同等の法的効力を持ち,電子記録の作成や修正,承認を行った各個人を特定できる唯一の手段」とER/ES関連規制では表現されています。
具体的にはコンピュータシステムへのログインやデータへのアクセス時にシステム管理者より認証された人であることを確認するための入力を行います。 このための手法は指紋照合などのバイオメトリックな方法とノンバイオメトリックな方法の二つに分けられます。
ノンバイオメトリックな方法では一般にユーザIDとパスワードの二つを組み合わせて用います。 ユーザIDとパスワードを用いる際の注意点として,この組み合わせがシステムの運用開始に遡って重複してはならないこと(一般的にはユーザIDは各個人固有のものにします)とシステム管理者といえども他人のパスワードを知っていてはならないことがあります。
また,IDやパスワードによる署名が有効になるのはクローズドシステム(管理者によりアクセスがコントロールされているシステム)の場合であり,オープンシステムの場合には暗号化を含む電子認証 (Digital Signature) を用いる必要があります。
■ 電子記録を行うためには?
電子記録を利用するためには,コンピュータ化システムバリデーション(CSV)により,コンピュータシステムの機能が正常に動作していると検証されていることが前提です。
前述のような電子記録と電子署名が適切に運用されるためには,使用されるコンピュータシステムはアクセス制限などのセキュリティが確保されたシステムであることが要求されます。
また,電子記録に関してはその作成,変更,削除などに対し「いつ」「誰が」「何を」「なぜ」行ったのかなどのオーディットトレイル情報が自動作成され,また,変更前の記録を上書きしないことが要求されます。データに対する付随データ(メソッドなど)が必要な場合もあります。一方,バックアップが手順化され,実施されなければなりません。 (アクセス制限やオーディットトレイルをはじめ上記については,LabSolutionsで対応できます。)
ER/ES関連規制への対応において,既存システム(レガシーシステム)を免責せず*,現在稼動しているシステムでの対応が求められています。 対応への企業理念(カンパニーポリシー)をまとめ,現状の全コンピュータシステムをリストアップすると共に,要求事項をまとめ,これらの間のギャップ分析を行うことがまず重要です。 その上で改善の優先順位やコストを分析し「今後の改善計画」を作成します。
もうひとつのポイントとして従業員へのトレーニングとその記録が挙げられます。また,電子署名については,電子署名の意味やその運用規定などを従業員が理解し,電子署名についての申告書に署名をしてもらいます。 その上でFDA対応時は,事前にFDAへ電子署名の使用を申告します。
* FDAファイナルガイダンスにより,一部要件を満たしている既存システムは免責されます。


